Research Article
Comparing the vestibular evoked myogenic potentials in patients with type Ι diabetes mellitus and normal people
Behnoush Kamali1, Fahimeh Hajiabolhassan1, Jamileh Fatahi1, Ensiyeh Nasliesfahani2, Javad Sarafzadeh3, Soghrat Faghihzadeh4
1- Department of Audiology, School of Rehabilitation, Tehran University of Medical Sciences, Iran
2- Gland Center, Shariati Hospital, Tehran University of Medical Sciences, Iran
3- Department of Physicaltherapy, School of Rehabilitation, Tehran University of Medical Sciences, Iran
4- Department of Biostatistics, Tarbiat Modarres University, Tehran, Iran
Received: 6 March 2012, accepted: 15 September 2012
Abstract
Background and Aim: Patients with type I diabetes mellitus commonly complain about dizziness, floating sensation, tinnitus, weakness, and sweating. The aim of this study was comparing vestibular evoked myogenic potentials (VEMPs) between these patients and normal people.
Methods: Twenty-four patients with type I diabetes mellitus and twenty-four healthy volunteers with the age range of 15-40 years were enrolled in this study. A tone burst of 500 Hz, with the intensity of 95 dB nHL, was delivered through a insert earphone and vestibular evoked myogenic potential was recorded. The t-test was used to compare the results between the two groups. To investigate the effect of glycated hemoglobin (HbA1c) on VEMP responses (latency, absolute and relative amplitude), the regression analysis was used.
Results: The mean p13 and n23 latency were significantly more in patients with type Ι diabetes mellitus (for P13 latency, p=0.013 in right and p=0.010 in left ear, and for n23 latency, p<0.001 in right and p=0.005 in left ear). There was no significant difference between two groups in absolute and relative amplitude and prevalence of the VEMP (p>0.050). There was no correlation between VEMPs and HbA1c in patients with type 1 diabetes mellitus (p>0.05).
Conclusion: Prolonged latencies of the VEMP in patients with type 1 diabetes mellitus suggest lesions in the retrolabyrinthine, especially in the vestibulospinal tract. Nevertheless, due to the limited number of examined samples, further investigation with more patients should be performed.
Keywords: Vestibular evoked myogenic potentials, saccule, sternocleidomasstoid muscle, vestibular System, type Ι diabetes mellitus
مقاله پژوهشی
بهنوش کمالی1، فهیمه حاجی ابوالحسن1، جمیله فتاحی1، انسیه نسلی اصفهانی2، جواد صرافزاده3، سقراط فقیهزاده4
1ـ گروه شنواییشناسی، دانشکدۀ توانبخشی، دانشگاه علوم پزشکی تهران، ایران
2ـ پژوهشکده غدد، مرکز دیابت، بیمارستان شریعتی، دانشگاه علوم پزشکی تهران، ایران
3ـ گروه فیزیوتراپی، دانشکدۀ توانبخشی، دانشگاه علوم پزشکی تهران، ایران
4ـ گروه آمار زيستي، دانشكده پزشكي، دانشگاه تربيت مدرس، تهران، ایران
چکیده
زمینه و هدف: بیماران دچار دیابت نوع Ι بهطور شایع از سرگیجه، احساس شناوربودن، وزوز، ضعف و عرقکردن شکایت دارند. مطالعۀ حاضر با هدف مقايسۀ پتانسیل عضلانی برانگیخته دهلیزی در افراد مبتلا به دیابت نوع Ι و افراد هنجار انجام شده است.
روش بررسی: اين مطالعه روي 24 فرد مبتلا به دیابت نوع Ι و 24 فرد داوطلب هنجار در محدودۀ سني 40-15 سال صورت گرفت. پتانسیل عضلانی برانگیختۀ دهلیزی گردنی با ارائۀ محرک تنبرست 500 هرتز با شدت 95 دسیبل nHL به ثبت رسید. برای مقایسۀ نتایج بین دو گروه از آزمون t مستقل و بررسي اثر هموگلوبین گلیکهشده بر پارامترهای پتانسیلهای عضلانی برانگیختۀ دهلیزی گردنی از آنالیز همبستگی استفاده شد.
یافتهها: میانگین زمان نهفتگی p13 و زمان نهفتگی n23 در مبتلایان به دیابت نوع Ι بیشتر از افراد هنجار بهدست آمد که این تفاوت از لحاظ آماری معنیدار بود. برای زمان نهفتگی p13، در گوش راست 013/0p= و در گوش چپ 01/0p= و برای زمان نهفتگی n23، در گوش راست 001/0p< و در گوش چپ 005/0p= بهدست آمد. تفاوتی بین میانگین دامنۀ مطلق و نسبت عدم تقارن و درصد وقوع پتانسیلها در دو گروه مشاهده نشد. هموگلوبین گلیکهشده نیز بر هیچیک از پارامترهای پاسخ در مبتلایان تأثيرگذار نبود(05/0p>).
نتیجهگیری: با توجه به مشاهدۀ زمان نهفتگی تأخیریافته در پاسخ بیماران دیابتی نوع Ι، احتمال ضایعه در ورای لابیرنت بهویژه در نوار دهلیزیـنخاعی ساقۀ مغز وجود دارد. با این وجود، به علت محدود بودن تعداد نمونههای مورد بررسی، نیاز به تحقیقات گستردهتری در اين مورد است.
واژگان کلیدی: پتانسیلهای عضلانی برانگیختۀ دهلیزی، ساکول، عضله جناغی چنبری پستانی، سیستم دهلیزی، دیابت نوع Ι
(دریافت مقاله: 16/12/90، پذیرش: 25/6/91)
Bittar و همکاران (1998) معتقدند متابولیسم گلوگز بهطور بارزی فیزیولوژی گوش داخلی را (که از لحاظ متابولیک بسیار فعال است) متأثر میکند. از آنجایی که گوش داخلی نمیتواند انرژی را ذخیره کند، تغییرات کوچک در گلوکز خون بر عملکرد آن اثر میگذارد و باعث اختلال تعادل میشود(2). بیماران مبتلا به اختلالات متابولیک از سرگیجه، احساس شناور بودن، وزوز، ضعف، عرق کردن و لرزش شکایت دارند(3). بیشتر محققان معتقدند که دیابت در انسان و حیوان ضایعات متفاوتی در گوش داخلی ایجاد میکند(4). با این وجود، مطالعات در این زمینه بسیار محدود است. از طرفی، در بیشتر موارد سیستم تعادل بیماران مبتلا به دیابت با استفاده از مجموعه آزمونهای الکترونیستاگموگرافی (Electronystagmography: ENG) ارزیابی شده است. Rigon و همکاران در سال 2007 با استفاده از ENG به بررسی سیستم دهلیزی افراد مبتلا به دیابت شیرین نوع I پرداختند. نتايج بررسی آنها حاکي از آن بود که آزمونهاي کالريک در 84/36 درصد از افراد مبتلا به ديابت نوع I دچار تغيير شده است(5). Gawron و همکاران در سال 2002 با استفاده از آزمونهای مختلف ENG مطالعهای را روی کودکان و جوانان مبتلا به دیابت نوع I انجام دادند که نتایج حاکی از آن بود که بين مدتزمان بيماري، هموگلوبين گليکه شده، شيوع حملات هيپوگليسمي و وجود نيستاگموس خودبهخودي و ناهنجاریهای اپتوکينتيک در افراد مبتلا به ديابت نوع I رابطۀ مستقيم وجود دارد(3). Nicholson و همکاران در سال 2002 به مقایسۀ رفلکس دهلیزی چشمی، رفلکس اپتوکینتیک و پوسچر در افراد مبتلا به دیابت شیرین وابسته به انسولین و دیابت شیرین غیروابسته به انسولین، و گروه شاهد فاقد دیابت پرداختند که نتایج بیانگر نقص در نگهداشتن نگاه خیره، رفلکس دهلیزیچشمی اپتوکینتیک در هر دو گروه وابسته و غیروابسته به انسولین داشت. تخریب سیستم عصبی مرکزی که در بیماران مبتلا به دیابت با سابقۀ طولانی رخ میدهد، باعث ایجاد اختلال در پتانسیلهای برانگیخته میشود. یافتههای الکتروفیزیولوژیک در چشم(4) و مسیرهای شنوایی(5)، آزمونهای ENG و پوسچروگرافی، همۀ مسیرها و ساختارهای عملکردی را ارزیابی نمیکنند. آزمونهای رایج در مجموعۀ ENG تنها مجاری نیمدایرهای و عصب دهلیزی فوقانی را مورد بررسی قرار میدهند. با اضافه شدن آزمون پتانسیلهای عضلانی برانگیختۀ دهلیزی (Vestibular Evoked Myogenic Potentials: VEMP) آزمایشگر قادر به ارزیابی عضوهای اتولیتیک سیستم دهلیزی بهویژه ساکول و عصب دهلیزی تحتانی خواهد بود(6).
پژوهشهایی که به بررسی ویژگیهای VEMP در بیماری دیابت پرداختهاند بسیار محدود هستند. تنها مطالعۀ منتشر شده در زمینۀ VEMP و افراد دیابتی، بهوسیلۀ Bektas و همکاران (2008) صورت گرفته است. در اين بررسي VEMP در بیماران مبتلا به دیابت نوع II با موارد هنجار مقایسه شده و در آن هیچ تفاوت آماری بارزی بین گروهها وجود نداشته است. پاسخهای VEMP در بیماران دیابتی نوع II با و بدون پلینوروپاتی طبیعی بوده است(7).
مطالعۀ حاضر با هدف مقایسۀ ویژگیهای VEMP، شامل دامنۀ مطلق، نسبت عدم تقارن، زمان نهفتگی مطلق در افراد مبتلا به دیابت نوع I و افراد هنجار صورت گرفت. از آنجاييکه میزان هموگلوبین گلیکه شده (Glycated Haemoglobin: HbA1c) منعکسکنندۀ ميانگين گلوکز پلاسما در دو تا سه ماه گذشته است و در هر زمانی از شبانهروز و در حالت غیرناشتا ميتوان آن را اجرا کرد، این آزمون برای ارزیابی کنترل گلیسمی در افراد دیابتی به یک استاندارد تبدیل شدهاست. در اين مطالعه اثر هموگلوبین گلیکه شده بر زمان نهفتگي p13، زمان نهفتگي n23، دامنۀ مطلق و نسبت عدم تقارن VEMP بهتفکيک بررسي شد.

روشبررسی
پژوهش حاضر از نوع مقطعیـمقايسهاي بود که روی 24 بيمار مبتلا به دیابت نوع I (10 زن و 14 مرد) با میانگین سنی04/24 و با انحراف معیار 05/6، که در آنان بر اساس پروتكل تشخيصي سازمان جهانی بهداشت 1999 (World Health Organization-1999) دیابت شیرین نوع یک بهوسيلۀ پزشک متخصص غدد به صورت قطعی تشخیص داده شده بود اجرا شد. همۀ اين افراد در محدودۀ سنی 40-15 سال قرار داشتند و مدتزمان ابتلا به ديابت آنها پنجسال و بالاتر بود. در این گروه، میانگین مدتزمان ابتلا به بیماری 45/10 سال با انحراف معيار 86/5 بود.
در
گروه هنجار
نیز 24 نفر (13 زن و 11
مرد) با
میانگین سنی 17/26
سال و انحراف
معیار 49/6 در
محدودۀ سني 40-15
سال، و بدون
هيچ سابقۀ شخصي
يا خانوادگي
از دیابت حضور
داشتند. افراد
شرکتکننده
در گروه مورد
و هنجار
بهروش
نمونهگیری
آسان انتخاب
شدند. عدم ابتلا
به درد گردن،
نداشتن
هرگونه
کمشنوایی و بیماریهای
سیستم دهلیزی
گوش در هر دو
گروه شرط لازم
برای ورود
افراد به
مطالعه بود.
این اطلاعات از
طریق
تاریخچهگیری
بهدستآمد.
برای اطمینان
از سلامت
دستگاه
شنوایی، معاینۀ
اتوسکپی،
ادیومتری تن
خالص (راه
هوایی و استخوانی)،
ادیومتری
ایمیتانس و
آزمون رفلکس
عضلۀ رکابی
انجام شد. سپس VEMP
در هر دو گروه
اجرا شد. نحوۀ
الکترودگذاری
بهاینگونه
بود که
الکترود مثبت
روی قسمت مياني
عضلۀ جناغيـچنبريـماستوئیدی،
الکترود منفي
روي انتهاي
بالايي
استخوان
جناغ، و
الکترود زمین
روی پیشانی قرار
داده میشد.
سپس فرد در
وضعیت دراز
کشیده قرار میگرفت
و با توجه به
لزوم انقباض
عضلۀ SCM در
هنگام ثبت،
بیمار سر خود
را اندکی
(تقريباً به
اندازۀ چهار
انگشت) بالا
میآورد. از
آنجايي که
دستگاه
ثبتکننده ميتواند
ميزان انقباض
عضله را
رديابي کند، فعالیت
عضله از طریق
الکترومیوگرافی
و بهصورت
چشمي ردیابی و
در یک سطح
ثابت نگهداشته
میشد (50 تا 200 میکروولت).
سپس گوشي
داخلی ER-3A در گوش
بيمار قرار میگرفت
و محرك ارائه
میشد. آزمون VEMP
با استفاده از
دستگاه ثبت
پتانسیلهای
برانگیختۀ
مدلBio-Logic �ساخت
شركت Natus آمريكا
و در کلينيک
شنواييشناسی
دانشکدۀ توانبخشي
دانشگاه علوم
پزشکي تهران،
از خرداد تا
مرداد 1390 انجام
شد. محرک تنبرست
500 هرتز با شدت 95
دسیبل nHL،
زمان فراز و
فرود 2 و
پلاتو صفر
میلیثانیه،
پلاريته
انبساطي و
تعداد 1/5� تحریک
در ثانیه از
طریق گوشی داخلي
به گوش ارائه
و ثبت میشد
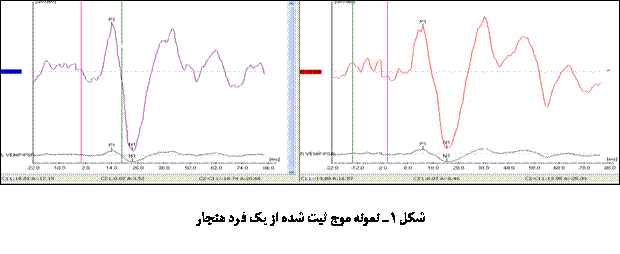
(شکل 1 و 2) میشد. شایان
ذکر است در
این پژوهش
تحريك
بهصورت
همانسویی و
پارامترهای
ثبت نيز
شامل تنظیم
بهرۀ
آمپلیفایر 5000
برابر، زمان
آنالیز
100ميليثانيه
و فیلتري با
پهناي باند 1500-10
هرتز بود.
دامنۀ مطلق
پاسخ که برابر
با بزرگی
ولتاژ بین دو
انتهای مثبت و
منفی مجموعۀ p13-n23
است و نسبت
عدم

تقارن که از تقسیم تفاضل دامنۀ اصلاح شده در دو گوش بر مجموع آنها بهدست میآید، همچنین زمان نهفتگی p13 و n23 مورد تجزیه و تحلیل آماری قرار گرفتند. اثر هموگلوبین گلیکه شده نیز، که میزان کنترل قند خون در طی سه ماه گذشته براساس بررسي پروندۀ پزشکي و مشاهدۀ نتايج آزمايش خون را نشان میدهد، بر پارامترهای ذکرشده در بالا، مورد بررسی قرار گرفت. برای رعايت ملاحظات اخلاقي، قبل از انجام آزمون رضايتنامهاي از افراد شركتكننده (بدون ذکر نام) مبنی بر استفاده از نتایج بهدست آمده در پژوهش گرفته شد.
باتوجه بهاینکه تعداد آزمودنیها در هر زیرگروه کمتر از30 نفر بود، از آزمون کولموگراف اسمیرنوف برای اطلاع از هنجار بودن توزیع دادهها استفاده شد. نتايج اين آزمون نشان داد که دادهها از توزیع هنجار برخوردار بودند. از این رو از آزمون t مستقل برای مقایسۀ زمان نهفتگی قلۀ p13 و n23، دامنۀ مطلق و نسبت عدم تقارن VEMP در افراد مبتلا به دیابت نوع I و افراد هنجار استفاده شد. اثر هموگلوبین گلیکه شده بر هریک از پارامترهای ذکر شده نیز با استفاده از آناليز همبستگی مورد بررسی قرار گرفت. دو گروه از لحاظ سنی همسانسازی شدند و میانگین سنی آنها با توجه بهسطح معنیداری 05/0p<، از لحاظ آماری تفاوت معنیداری نداشت(05/0p>).
یافتهها
موج VEMP
در 100 درصد
افراد هنجار و
مبتلا به
ديابت نوع I
وجود داشت.
میانگین زمان
نهفتگی p13
در گروه
بیماران در
گوش راست 51/15
میلیثانیه
با انحراف معیار
43/1 و در گوش چپ 49/15
میلیثانیه
با انحراف معیار
42/1 بهدستآمد.
میانگین و
انحراف معیار
زمان نهفتگی n23
پاسخ VEMP نیز در
گروه بیماران
در گوش راست 53/25
میلیثانیه
با انحراف معیار
84/2 و در گوش چپ
57/24
میلیثانیه
با انحراف معیار
30/2 ثبت شد.
در گروه هنجار
نیز میانگین
زمان نهفتگی p13
در گوش راست 67/14
میلیثانیه
با انحراف معیار
69/0 و در گوش چپ
61/14 میلیثانیه
با انحراف معیار73/0
بود. در اين
گروه در گوش
راست میانگین
زمان نهفتگی n23
پاسخ 06/23
میلیثانیه
با انحراف معیار
15/1 و در
گوش چپ 98/22
میلیثانیه
با انحراف معیار
19/1 بهدستآمد.
بین مقادیر
زمان نهفتگی p13 و
زمان نهفتگی n23
در دو گروه
تفاوت وجود داشت
و این تفاوت
از لحاظ آماری
معنیدار بود.
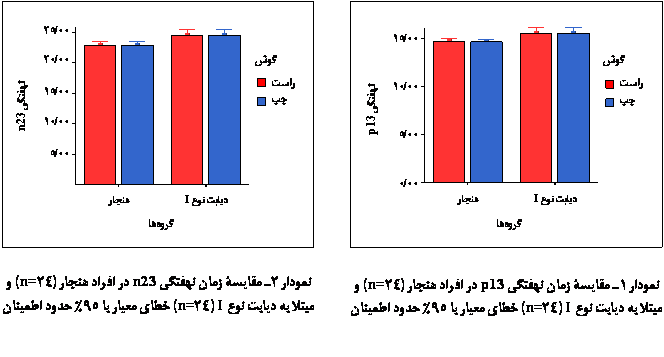
در واقع
میانگین زمان
نهفتگی p13
در گروه
بیماران
بیشتر از
افراد هنجار
(برای گوش
راست 013/0p= و برای
گوش چپ 01/0p=)
بود (نمودار 1)،
و میانگین
زمان نهفتگی n23
نیز در گروه
بیماران
بیشتر از
افراد هنجار (گوش
راست 001/0p= و گوش
چپ 005/0p=) بود (نمودار
2). مقادیر
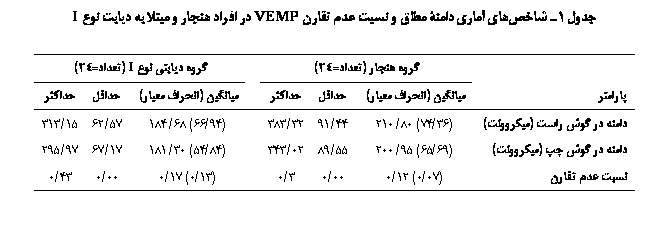
دامنۀ مطلق بر
حسب ميکروولت
و نسبت عدم
تقارن در دو
گروه تفاوت
معنيداری
نشان نداد
(دامنۀ مطلق گوش
راست 20/0p= و گوش چپ 26/0p= و
نسبت عدم
تقارن 12/0p=)
که در جدول 1
آمده
است. در
افراد مبتلا
به دیابت نوع I
متوسط میزان
هموگلوبین
گلیکهشده 12/8
با انحراف معيار
11/1 بود. با
استفاده از
آناليز
همبستگی مشخص
شد که بين
مقدار
هموگلوبين
گليکه شده و
زمان نهفتگي p13 و n23،
دامنۀ مطلق و
نسبت عدم
تقارن
همبستگي معنيداري
وجود ندارد (جدول
2).
بحث
 هیپرگلیسمی
مزمن دیابت با
اختلال
عملکرد و نقص
عضوهای
گوناگون بهویژه
چشمها،
کلیهها،
اعصاب، قلب و
رگهای خونی
مرتبط است(1). دیابت
شيرين حتی در
صورت فقدان
هرگونه شکایت
نورولوژیک
نیز میتواند
عضو دهلیزی را
متأثر سازد(5).در
اين مطالعه
وقوع پاسخ VEMP
در افراد
هنجار و مبتلا
به ديابت شیرین
نوع I برابر با 100
درصد بود؛
يعني در کل
افراد مورد مطالعه
پاسخ VEMP وجود داشت.
نبود پاسخ VEMP
منعکسکنندۀ
وجود ضایعۀ
مؤثر بر مسیر
ساکولوکولیک
است که از
ماکولای
ساکول شروع
شده و از طریق
نوار دهلیزیـنخاعی
سیر نزولی خود
را بهسمت
عضلههای SCM
طی میکند(6). در
تحقیق حاضر
اگر چه
ناهنجاریهایی
در پتانسیلهای
ثبت شدۀ افراد
مبتلا
هیپرگلیسمی
مزمن دیابت با
اختلال
عملکرد و نقص
عضوهای
گوناگون بهویژه
چشمها،
کلیهها،
اعصاب، قلب و
رگهای خونی
مرتبط است(1). دیابت
شيرين حتی در
صورت فقدان
هرگونه شکایت
نورولوژیک
نیز میتواند
عضو دهلیزی را
متأثر سازد(5).در
اين مطالعه
وقوع پاسخ VEMP
در افراد
هنجار و مبتلا
به ديابت شیرین
نوع I برابر با 100
درصد بود؛
يعني در کل
افراد مورد مطالعه
پاسخ VEMP وجود داشت.
نبود پاسخ VEMP
منعکسکنندۀ
وجود ضایعۀ
مؤثر بر مسیر
ساکولوکولیک
است که از
ماکولای
ساکول شروع
شده و از طریق
نوار دهلیزیـنخاعی
سیر نزولی خود
را بهسمت
عضلههای SCM
طی میکند(6). در
تحقیق حاضر
اگر چه
ناهنجاریهایی
در پتانسیلهای
ثبت شدۀ افراد
مبتلا
به دیابت نوع I
دیده شد، اما
احتمالاً شدت
ضایعه در حدی
نبوده که منجر
به حذف پاسخ
در آنها شود.
در
مطالعۀ حاضر
زمان نهفتگی
امواج p13 و n23 در
بیماران با
دیابت شیرین
نوع I نسبت به افراد
هنجار تفاوت
معنیداری
داشت، و
میانگین آن در
گروه بیماران
بیشتر از
افراد هنجار
بهدست آمد.
برخی مطالعات
گزارش کردهاند
که
میکروآنژیوپاتی
(رتینوپاتی،
نفروپاتی، و
نوروپاتی)
ممکن است
مسئول
تغییرات عملکرد
گوش داخلی
مرتبط با
دیابت شیرین
باشد(4). تنها
مطالعۀ
صورتگرفته
با استفاده از
VEMP
در افراد
دیابتی، در
سال 2008
بهوسیلۀ Bektas و
همکاران
انجام شده است
که در آن
پاسخهای VEMP
در بیماران با
دیابت شیرین
نوع II با و بدون
نوروپاتی و
افراد هنجار
مقایسه شد، و
در آن هیچ
تفاوت آماری
بارزی بین
گروهها وجود
نداشت(7). این
نتایج با
نتایج مطالعۀ
حاضر در تناقض
است، که دلیل
احتمالی آن
ممکن است بررسی
پاسخ VEMP در
گروههای
متفاوتی از
بیماران
دیابتی در این
دو تحقیق
باشد. در دو
بیمار
شرکتکننده
در مطالعۀ
حاضر زمان
نهفتگی p13
بهصورت
یکطرفه از 20
میلیثانیه و
زمان نهفتگی n23
از 30
میلیثانیه
فراتر بود، و
در یک بیمار
نیز
صرفاً
زمان نهفتگی n23
(بهصورت
یکطرفه)
بالاتر از 30
میلیثانیه
بود، که در هر
سه مورد
میانگین
مدتزمان ابتلا
به بیماری
بیشتر از 15 سال
بود. بهنظر
میرسد برای
افزایش زمان
نهفتگی VEMP به فراتر از
حد طبیعی تنها
آسیب به عصب
دهلیزی
ناکافی باشد و
ضایعات ساقۀ
مغز، بهویژه
آنهایی که
نوار دهلیزی
نخاعی را
درگیر
میکنند، در
افزایش زمان
نهفتگی p13
دخالت داشته
باشند. افزايش
زمان نهفتگي
امواج p13 و n23 در
سکتههاي بخش
پاييني ساقۀ
مغز و اسکلروز
متعدد نیز
ديده شده
است(8). Perez و همکاران
(2001) ضایعۀ
عملکردی عضو
انتهایی دهلیزی
در موشهای
آزمایشگاهی
دیابتی را با
استفاده از
پتانسیلهای
برانگیختۀ
دهلیزی با نهفتگی
کوتاه (Vestibular short Evoked Potentials: VsEPs) نشان
دادند. نتایج
بهدستآمده
حاکی از نهفتگی
طولانی شده و
کاهش دامنۀ
اولین موج VsEPs داشت، که
منعکسکنندۀ
بخش دهلیزی
گوش داخلی است(9).
یافتههای Gawron
و همکاران (2002)
گزارش کردند
که اختلالات
متابولیکی
ایجاد شده در
دیابت نوع I
باعث تغییرات
در بخشهای
گوناگون عضلۀ
دهلیزی و
بهویژه در
بخش مرکزی
میشود(3).
اگرچه میدانیم
که دیابت
شیرین بیشتر
سیستمهای
ارگانیک بدن
را متأثر
میکند و اکثر
بیماران با دیابت
شیرین شکایات
دهلیزی
دارند، با این
حال هنوز روشن
نیست کدام بخش
از سیستم دهلیزی
بیشتر متأثر
میشود.
اختلال
عملکرد دهلیزی
ناشی از
هیپرگلیسمی
ممکن است
مرکزی(3) یا
محیطی(10) باشد.
هیپرگلیسمی،
هیپوگلیسمی و
هر نوع تغییر
ملایم دیگر در
سطوح انسولین
کافی است تا
باعث ایجاد
تغییرات و
متأثر شدن
لابیرنت شود.
مشخص شده است
که ساختارهای
لابیرنتی، و
بهویژه
نوارعروقی،
به فعالیت
متابولیک
بسیار حساس
بوده، و به
ذخیرۀ اکسیژن
ثابت و مناسب،
و تریفسفات
آدنوزین (ATP)
وابستهاند.
منابع انرژی
عظیمی برای
تمرکز کافی
سدیم و پتاسیم
در آندولنف
مورد نیاز
است، و گلوکز
برای تولید ATP
درون سلولها
و ذخیرۀ انرژی
برای عملکرد
مناسب پمپ
سدیمـپتاسیم
بسيار حیاتی
است. برای
مثال،
تغییرات متابولیکی
که متابولیسم
گلوکز را
درگیر میکند،
ممکن است باعث
آسیب به ذخیرۀ
انرژی و تغییر
در تمرکز
یونها در
آندولنف و
پریلنف شود و
بهاین طریق
باعث تغییر در
پتانسیلهای
الکتریکی
لابیرنت شده و
احساس گیجی را
به همراه
داشته باشد.
فقدان گلوکز
بهعنوان
منبع انرژی
برای فعالیت پمپ
سدیمـپتاسیم
باعث ایجاد
هیدروپس
آندولنف ناشی
از حفظ سدیم
در فضای
آندولنفاتیک
و در پی آن
افزایش حجم آب
در چنین قسمتی
میشود(11). گوش
داخلی بهطور
ویژه به تغییر
سطح گلوکز و
انسولین خون
حساس است، و
معمولترین نشانههای
آن سرگیجه،
کمشنوایی،
وزوز، احساس
پری گوش و
موارد دیگر
است. بهعلت
وابستگی نوار
عروقی به
تمرکز گلوکز
خون، تغییرات
گلوکز خون
باعث
اختلالات
شنوایی و
تعادل
میشود(12).
همانطور که
قبلاً نیز ذکر
شد، مطالعاتی که
به بررسی VEMP
در افراد
دیابتی
پرداختهاند
بسیار محدود هستند،
اما اختلال در
آزمونهای
دهلیزی مثل ENG
که در بیماران
با دیابت
شیرین دیده
میشود، از
وجود موارد
غیرطبیعی در
مسیر 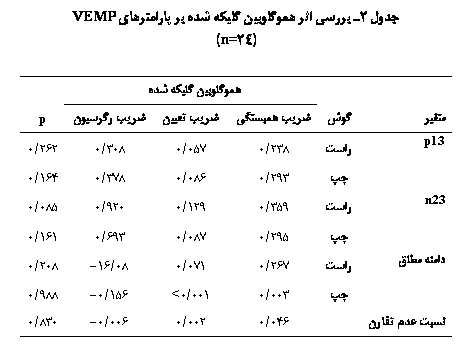 مرکزی
حمایت
میکند(3). Jerger و Jerger (1998) عنوان
کردند که ممکن
است 20 درصد از
بیماران با
دیابت شیرین دچار
احساس گیجی (dizzines)
باشند(10). Biurran و
همکاران (1991)
نتایج ENG غیرطبیعی
بدون هیچ
شکایتی را در
بیش از 50 درصد بیماران
دیابتی گزارش
کردند. آنها
هفت مورد (2/5%) نیستاگموس
خودبهخودی و
12 مورد (1/26%) نیستاگموس
وضعیتی را
گزارش کردند(5). Almeida (1998) 28 مورد،
یعنی بیش از 50
درصد، تغییر
در آزمونهای
کالریک را
گزارش کرد(12)،
که درآن تعقیب
آرام دومین
آزمون تغییر
یافته بود.
مطالعۀ Rafaele Rigon
و همکاران در
سال 2007 روی
سیستم دهلیزی
افراد مبتلا
به دیابت
شیرین نوع I
نشانداد که
اختلال در
الکترونیستاگموگرافی
در 84/36 درصد (7نفر)
از افراد با
دیابت شیرین
نوع I وجود
دارد(6). Gawron و
همکاران (2002)
عنوان کردند
که آزمونهای
دهلیزی در
شناسایی
اختلالات
سیستم عصبی
مرکزی در
بیماران با
دیابت شیرین
حساستر از
آزمونهای ادیولوژیک
است(3).
اختلالات
متابولیک
میتواند هومئوستازی
اندام دهلیزی
را سریعتر از
سیستم شنوایی
متأثر کند.
اما در تعدادی
از مطالعات،
آزمونهای
ادیولوژیک
نیز متأثر
شدهاند. Murbach و
همکاران (2003)
دریافتند که
در طول
هیپوگلیسمی و
هیپرانسولمی،
یک تغییر
دامنۀ منفی
در DPOAE ایجاد
میشود(13). Mendelson و Roderique
(1972) نشاندادند
که در طول فاز
هیپوگلیسمی،
پتانسیل داخل
حلزونی و
میکروفنی
حلزون (CM) دچار
کاهش
میشوند، و با
کاهش تمرکز
پتاسیم و
افزایش تمرکز
سدیم در
آندولنف
مرتبط است، که
در نهایت باعث
حساسیت (تحریکپذیری)
دستگاه
شنوایی مرتبط
با تغییر در
تحریکات
آندولنف
میشود(14). Camisasca (1961) کمشنوایی
حسی عصبی را
در 46 درصد از
بیماران با
دیابت شیرین گزارش
کردند. اگرچه
درجه و شکل
کمشنوایی در
این مطالعه
ذکر نشده بود(15).
وجود
ناهنجاری در
مسیر
اکوستیکی نیز
در بیماران با
دیابت شیرین
گزارش شده است.
در یک مطالعه
با استفاده از
ABR،
شنوایی
کودکان با
دیابت شیرین
ارزیابی شد، که
در آن محققان
تأخیر در ثبت
موج I را در 93 درصد
از گوشهای
مورد آزمون، و
تأخیر موج III
را در 73 درصد از
گوشها گزارش
کردند(16).
گزارشهای
دیگری وجود
دارد که در
آنها
هیچگونه
اختلالی در
ارگان شنوایی
محیطی و مرکزی
افراد دیابتی
دیده نشدهاست.
این نتایج
بیانگر
پاتوفیزیولوژی
پیچیدۀ دیابت
شیرین و
ویژگیهای
فردی بیماران
دیابتی است.
شواهد عینی
نشان دادهاند
که وجود
اختلال محیطی
در دیابت
شیرین کمتر از
موارد مرکزی
است.
مرکزی
حمایت
میکند(3). Jerger و Jerger (1998) عنوان
کردند که ممکن
است 20 درصد از
بیماران با
دیابت شیرین دچار
احساس گیجی (dizzines)
باشند(10). Biurran و
همکاران (1991)
نتایج ENG غیرطبیعی
بدون هیچ
شکایتی را در
بیش از 50 درصد بیماران
دیابتی گزارش
کردند. آنها
هفت مورد (2/5%) نیستاگموس
خودبهخودی و
12 مورد (1/26%) نیستاگموس
وضعیتی را
گزارش کردند(5). Almeida (1998) 28 مورد،
یعنی بیش از 50
درصد، تغییر
در آزمونهای
کالریک را
گزارش کرد(12)،
که درآن تعقیب
آرام دومین
آزمون تغییر
یافته بود.
مطالعۀ Rafaele Rigon
و همکاران در
سال 2007 روی
سیستم دهلیزی
افراد مبتلا
به دیابت
شیرین نوع I
نشانداد که
اختلال در
الکترونیستاگموگرافی
در 84/36 درصد (7نفر)
از افراد با
دیابت شیرین
نوع I وجود
دارد(6). Gawron و
همکاران (2002)
عنوان کردند
که آزمونهای
دهلیزی در
شناسایی
اختلالات
سیستم عصبی
مرکزی در
بیماران با
دیابت شیرین
حساستر از
آزمونهای ادیولوژیک
است(3).
اختلالات
متابولیک
میتواند هومئوستازی
اندام دهلیزی
را سریعتر از
سیستم شنوایی
متأثر کند.
اما در تعدادی
از مطالعات،
آزمونهای
ادیولوژیک
نیز متأثر
شدهاند. Murbach و
همکاران (2003)
دریافتند که
در طول
هیپوگلیسمی و
هیپرانسولمی،
یک تغییر
دامنۀ منفی
در DPOAE ایجاد
میشود(13). Mendelson و Roderique
(1972) نشاندادند
که در طول فاز
هیپوگلیسمی،
پتانسیل داخل
حلزونی و
میکروفنی
حلزون (CM) دچار
کاهش
میشوند، و با
کاهش تمرکز
پتاسیم و
افزایش تمرکز
سدیم در
آندولنف
مرتبط است، که
در نهایت باعث
حساسیت (تحریکپذیری)
دستگاه
شنوایی مرتبط
با تغییر در
تحریکات
آندولنف
میشود(14). Camisasca (1961) کمشنوایی
حسی عصبی را
در 46 درصد از
بیماران با
دیابت شیرین گزارش
کردند. اگرچه
درجه و شکل
کمشنوایی در
این مطالعه
ذکر نشده بود(15).
وجود
ناهنجاری در
مسیر
اکوستیکی نیز
در بیماران با
دیابت شیرین
گزارش شده است.
در یک مطالعه
با استفاده از
ABR،
شنوایی
کودکان با
دیابت شیرین
ارزیابی شد، که
در آن محققان
تأخیر در ثبت
موج I را در 93 درصد
از گوشهای
مورد آزمون، و
تأخیر موج III
را در 73 درصد از
گوشها گزارش
کردند(16).
گزارشهای
دیگری وجود
دارد که در
آنها
هیچگونه
اختلالی در
ارگان شنوایی
محیطی و مرکزی
افراد دیابتی
دیده نشدهاست.
این نتایج
بیانگر
پاتوفیزیولوژی
پیچیدۀ دیابت
شیرین و
ویژگیهای
فردی بیماران
دیابتی است.
شواهد عینی
نشان دادهاند
که وجود
اختلال محیطی
در دیابت
شیرین کمتر از
موارد مرکزی
است.
در پژوهش حاضر بين مقادير دامنۀ مطلق و نسبت عدم تقارن تغییرات معنیداری بین دو گروه دیده نشد. در مطالعۀ Bektas و همکاران در سال 2008 نيز دامنۀ مطلق افراد هنجار نسبت به افراد مبتلا به ديابت تفاوتي نشان نداد. اگرچه در مطالعۀ آنها افراد مبتلا به ديابت نوع II مورد بررسي قرار گرفتند(7). نسبت عدم تقارن که بيانگر اختلال دهليزي يکطرفه است و براي اولين بار در افراد ديابتي مورد بررسي قرار گرفت، تفاوتي در بين افراد دو گروه نشان نداد. البته در یک مورد از بیماران دیابتی میزان نسبت عدم تقارن بالا بود که احتمالاً بهدلیل اختلال دهلیزی یکطرفه است. این متغیر برای اولینبار در افراد دیابتی مورد بررسی قرار گرفت، و یکی از دلایل عدم معنیداری آن میتواند حجم کم نمونه در این مطالعه باشد.
بين مقدار هموگلوبین A1C، که بهترين شاخص براي بررسي روند کنترل قند خون در افراد ديابتي است، و پارامترهای VEMP همبستگي وجود نداشت. ازآنجايي که هموگلوبین A1C ميزان تغييرات قند خون در طي سه ماه گذشته را نشان ميدهد، ميتوان نتيجه گرفت که تغيير سطح قند خون تأثيري بر VEMP نداشته است. تاکنون در هیچ مطالعهای اثر هموگلوبین A1C بر پارامترهای VEMP مورد مطالعه قرار نگرفته است، اما در مطالعهای که بهوسیلۀ Gawron و همکاران در سال 2002 صورت گرفت، میزان ناهنجاریهای دهلیزی وابسته به وجود و ویژگی حملات هیپوگلیسمی و مدتزمان بیماری بود، ولی ارتباطی بین هموگلوبین A1C و نتایج ENG وجود نداشت(3). اگرچه از نظر عدم تأثیر A1C بر سیستم دهلیزی با مطالعۀ حاضر مطابقت داشت، اما بهنظر میرسد بررسی با تعداد نمونههاي بيشتر در این زمینه ضروری است. با وجود این که افراد این تحقیق براساس پروتکل ارجاع داده شدند، اما بیماران دیابتی ممکن است هویت نامتناجس داشته باشند که این مسئله نیز میتواند بر دادههای الکتروفیزیولوژیک تأثیرگذار بوده و همچنین محدودیتی برای این تحقیق به حساب آید.
بهدلیل افزایش زمان نهفتگی امواج VEMP در افراد با مدتزمان بیشتر بیماری، بررسی پاسخ VEMP براساس مدتزمان ابتلا به بیماری در مطالعهای دیگر قابل توصیه است. افزایش زمان نهفتگی p13 در بیماران دیابتی نسبت به افراد هنجار از لحاظ آماری معنیدار بود، اما بهنظر میرسد از لحاظ بالینی به بررسی بیشتر و ارزیابی تعداد نمونههای بالاتر نیاز است. از آن جایی که افزايش زمان نهفتگی n23 نیز معنیدار بود، بررسی زمان نهفتگی امواج دیگر VEMP، از جمله p2-n2، نیز توصیه میشود. همچنین بررسی اثر تعداد و شدت حملات هیپوگلیسمی بر پاسخهای VEMP نیز از دیگر پیشنهادات این مطالعه است.
نتیجهگیری
یافتههای اصلی این پژوهش شامل افزایش زمان نهفتگی p13 و n23 در بیماران مبتلا به دیابت نوع I بود، که بیانگر درگیری ساکول و مسیرهای عصبی مربوط به آن است.
اگرچه محل هدف مکانیزمهای بیماری دیابت نوع I که مسئول ایجاد ناهنجاری در VEMP هستند درساختارهای دهلیزی محیطی یا مرکزی یا هر دو بهطور قطعی آشکار نیست، با توجه به افزایش زمان نهفتگی p13 و n23 احتمال درگیری نوار دهلیزیـنخاعی در ساقۀ مغز وجود دارد. بهعلت محدود بودن تعداد نمونههای مورد بررسی، برای تعمیم نتایج بهکل بیماران دچار دیابت نوع I نیاز به تحقیقات گستردهتری است.
سپاسگزاری
از همکاران محترم گروه شنواییشناسی دانشکدۀ توانبخشی دانشگاه علوم پزشکی تهران، بهویژه جناب آقای دکتر فراهانی مدیر محترم گروه، بهخاطر در اختیار گذاشتن امکانات و تجهیزات و حمایتهای بیدریغشان تشکر و قدردانی میشود. همچنین مراتب سپاس و قدردانی خود را از کارکنان محترم مرکز دیابت بیمارستان شریعتی تهران، بهویژه سرکار خانم افضلزاده، و نیز تمامی افرادی که در این پژوهش شرکت کردند اعلام میداریم. خاطرنشان میسازد این پژوهش حاصل پایاننامۀ کارشناسی ارشد است که با حمایتهای مالی دانشگاه علوم پزشکی تهران انجام گرفت.
REFERENCES
1. American diabetes association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2005;28 (Suppl 1):537-42.
2. Bittar RSM, Sunchez TG, Santoro PP, Medeiros IRT. O metabolismo da glicose e o ouvido interno. Arq Otorrinolaryngol. 1998;2(1):39-44. Portuguese.
3. Gawron W, Pospiech L, Orendorz-Fraczkowska K, Noczynska A. Are there any disturbances in vestibular organ of children and young adults with type I diabetes? Diabetologia. 2002;45(5):728-34.
4. Biurrun O, Ferrer JP, Lorente J, De Espana R, Gomis R, Traserra J. Asymptomatic electronystagmographic abnormalities in patients with type I diabetes mellitus. ORL J otorhinolaryngol Relat Spec.1991;53(6):335-8.
5. Rigon R, Rossi AG, Coser PL. Otoneurologic findings in type 1 diabetes mellitus patients. Braz J Otorrinolaringol. 2007;73(1):100-5.
6. Hall JW. New handbook of auditory evoked responses. 2nd ed. Boston: Pearson education Inc; 2007.
7. Bektas D, Gazioglu S, Arsalan S, Cobanoglu B, Boz C, Caylan R.VEMP responses are not affected in non-insulin-dependent diabetes mellitus patients with or without polyneuropathy. Acta OtoLaryngol. 2008;128(7):768-71.
8. Murofushi T, Shimizu K, Takegoshi H, Cheng PW. Diagnostic value of prolonged latencies in the vestibular evoked myogenic potential. Arch Otolaryngol Head Neck Surg. 2001;127(9):1069-72.
9. Perez R, Ziv E, Freeman S, Sichel JY, Sohmer H. Vestibular end-organ impairment in an animal model of type 2 diabetes mellitus. Laryngoscope. 2001;111(1):110-3.
10. Jerger S, Jerger J. Altera��es auditivas: um manual para avalia��o cl�nica. 1st ed. S�o Paulo: Atheneu; 1998.
11. Serra AP, Lopes Kde C, Dorigueto RS, Ganan�a FF. Blood glucose and insulin levels in patients with peripheral vestibular disease. Braz J Otorhinolaryngol. 2009;75(5):701-5.
12. Almeida FS. Disfun��o metab�lica tire�idea e otoneurologia. Braz� J Otorhinolaringol. 1998;64(4):351-8.
13. Murbach VF, Caovilla HH, Munhoz MSL, Ganan�a MM, Guerrero AI. Distortion product otoacoutic emissions amplitude variations during glucose tolerance test and insulin titration. Acta ORL. 2003;22(4):32-42.
14. Mendelsohn M, Roderique J. Cationic changes in endolymph during hypoglycemia. Laryngoscope. 1972;82(8):1533-40.
15. Jorgensen MB, Buch NH. Studies on inner-ear function and cranial nerves in diabetics. Acta Otolaryngol 1961;53:350-64.
16. Goldsher M, Pratt H, Hassan A, Shenhav R, Eliacher I, Kanter Y. Auditory brainstem evoked potentials in insulin-dependent diabetics with and without peripheral neuropathy. Acta Otolaryngol. 1986;102(3-4):204-8.