اسیدهای چرب امگا3 (omega 3) از خانوادۀ اسیدهای چرب غیراشباع مرکب (polyunsaturated fatty acids: PUFAs) هستند. سه نوع اسید چرب امگا3 وجود دارد که در سوختوساز بدن نقس اساسی ایفا میکنند: آلفاـلینولنیک اسید (alpha-linolenic acid: ALA; 20:3) تنها اسید چرب ضروری که بدن قادر به سنتز آن نیست؛ ایکوزاپنتانوئیک اسید (eicosapentaenoic acid: EPA; 20:5) و دکوزاهگزانوئیک اسید (docosahexaenoic acid: DHA; 22:6) که هر دو اسید چرب با زنجیرۀ طولانی محسوب میشوند و بدن میتواند از آلفاـلینولنیک اسید بهعنوان نقطۀ شروعی برای سنتز آنها استفاده کند(4-1)؛ هرچند تحقیقات نشان میدهد که میزان تبدیل آلفاـلینولنیک اسید به EPA و DHA کم است و این دو ماده که نقش اساسی در فرایند زیستی بازی میکنند، باید از طریق رژیم غذایی دریافت شوند(5و6).
برهمکنش اسیدهای چرب امگا3 و امگا6، اثرات زیستی آنها را تعیین میکند و این برهمکنش بهشدت بر عملکردهای مختلف تأثیرگذار است(7). نقشهایی همچون شکلدهی ایکوسانوئید (مولکولهای سیگنالینگ بهعنوان پیغامبر در CNS)، لیپوکسین (ضد التهاب)، تشکیل تکههای لیپیدی (مؤثر در سیگنالینگ سلولی) و فعالکنندۀ عوامل رونویسی اسید دئوکسی ریبونوکلئیک Deoxyribonucleic acid: DNA)) تنها گوشهای از تأثیرات این مواد در بدن است. همچنین مطالعاتی به نقش منحصربهفرد اسیدهای چرب در رشد سیستم عصبی و انتقال نورونی اشاره میکنند(10-8). اسیدهای چرب امگا3، بهویژه DHA نقش بسیار مهمی در تکامل مغز و سیستم عصبی (40درصد PUFAs در مغز)، شبکیه (60 درصد PUFAs در شبکیه) و غشای پلاسمایی نورونها (50 درصد وزن غشای پلاسمایی) ایفا میکنند. DHA تنظیمکنندۀ انتقال با واسطۀ حامل (carrier-mediated) تورین، گلایسین و کولین است و عملکرد كانال پتاسيم یکسوساز تأخیری را منظم میکند(11و12) و نیز در تنظیم بیان ژن(13) و میلینهسازی اعصاب که در سیستم شنوایی هم نقش دارند دارای نقش اساسی است(14). امروزه، به دلیل تغییر رژیم غذایی متداول در جهان و کمبود مصرف اسیدهای چرب امگا3 نسبت به امگا6، شیوع بیماریهای گوناگون با اثرگذاری بر سیستمهای گوناگون بدن افزایش پیدا کرده است و این باعث توجه به اصلاح روند رژیم غذایی و توجه به نقش امگا3 و در نتیجه برقراری تعادل بین امگا3 و امگا6 شده است(15). این نقش در حیطههای تولد و رشد جنین و نوزاد، مغز و سیستم اعصاب، گسترۀ شناختیـعصبی، بینایی، ترکیبات لیپیدی ارگانهای مختلف، شنوایی و چندین حیطۀ دیگر مورد توجه و بررسی قرار گرفته است. مطالعۀ حاضر با هدف بررسی نتایج پژوهشهای انجام شده دربارۀ امگا3 در حیطههای رشدی و عصبی صورت گرفت و در آن، اثر امگا 3 بر حوزۀ شنوایی مرور و جمعبندی شد.
روش بررسی
در این مطالعه مقالاتی که از سال 1970 تا 2013 دربارۀ امگا3 و شنوایی منتشر شده است بررسی شد. مقالات با کلید واژههای omega3 و auditory بهصورت ترکیبی از بانکهای اطلاعاتی Medline، Google Scholar، PubMed، Cochrane Library و SID استخراج و پس از بررسی و مرتبط بودن با موضوع در این مقاله استفاده شد.
تولد و رشد
این واقعیت که مصرف امگا3 (اسید چرب اشباعنشده با زنجیرۀ بلند) عامل مهمی در دوران بارداری بهشمار میآید، تعجبآور نیست. این ماده بهمیزان فراوانی در بافتهای جنین در دورۀ دوم بارداری تجمع پیدا میکند(16). از آنجاییکه سلولهای پستانداران فاقد آنزیمهای غیر اشباعکننده delta12 و delta15 هستند، به رژیم غذایی حاوی امگا3 و 6 غیراشباع نیاز دارند. هرچند زنان در سن باروری توانایی بالاتری برای تبدیل DHA و EPA نسبت به مردان دارند(17)، با اینحال بهدلیل میزان تبدیل پایین این مواد، آنها نیز مجبور به مصرف مکملهای غذایی هستند(18). میانگین رژیم غذایی حاوی امگا3 در دوران بارداری در جهان از 9 درصد تا 89 درصد از انرژی است(19). در مطالعات زیادی، از جمله در پژوهش Halldorsson و همکاران (2007)، ارتباط میان مصرف ماهی در دوران بارداری و رشد جنین بررسی شده است که در آنها موارد فراوانی از وزن پایین نوزادان در زنانی که مصرف بیشاز 60 گرم ماهی در روز داشتند دیده شد(20)؛ هرچند بعضی از محققان معتقدند که اثرات دیده شده بر رشد جنین ممکن است بهدلیل آلودگی ماهی با آلایندهها باشد(21). بررسی مطالعات انجام شده نشان میدهد استفاده از مقادیر مناسب رژیم غذایی حاوی امگا3 نقش مهمی در رشد و تکامل بازی میکند، بهطوری که مصرف کمتر یا بیشتر از حد آن آثار جبران ناپذیری بر تکامل دارد. تحقیقات نشاندهندۀ آناست که مصرف امگا3 در دوران بارداری موجب طولانیشدن دورۀ بارداری و افزایش وزن نوزادان در هنگام تولد میشود و بروز و شدت تولدهای زودرس، وزن و دور سر کمتر در هنگام تولد را کاهش میدهد(26-22). این تأثیرات بهویژه از سه ماهۀ آخر بارداری تا دو سالگی بعداز تولد نوزاد با رویارویی کودک با تحریکات محیطی و بهویژه در مغز ادامه دارد(6و27). بنابراین دوزهای بالاتر اسید چرب امگا3 برای زنان باردار و مراقبت از نوزادان برای سلامتی رشدی نوزادان زودرس، و کموزن به هنگام تولد و حتی نوزادان طبیعی توصیه میشود(23،28و29).
با وجود فواید مصرف امگا3، فزونی مصرف آن نیز آثار مخربی بهدنبال دارد و ممکن است حتی مخربتر از کمبود مصرف آن باشد. شواهدی وجود دارد که رژیم غذایی غنی از امگا3 میتواند برای جنین و نوزاد مضر باشد. نتایج تعدادی از مطالعات انسانی کاهش طول بارداری، عقبماندگی جنین(34-30) کاهش شاخص تودۀ بدن(35)، کاهش اندازۀ جمجمه و افزایش مرگ و میر نوزادان(26)، کاهش دور سر(36)، کاهش رشد بدن(36و37) و سطح اسید آراشیدونیک (Arachidonic acid: AA; 20:4) را نشان میدهد(37و38). مطالعات حیوانی نیز تأییدکنندۀ آن است که مکملهای غذایی با مقادیر بالایی از امگا3 یا نسبت امگا3 به امگا6 بالا در دوران بارداری و یا بعد از زایمان ممکن است به کاهش وزن هنگام تولد، اختلال رشد پس از تولد، افزایش مرگ و میر قبل و بعد از تولد، کاهش اندازۀ مغز، کاهش سطح AA، ساختار/عملکرد غیرطبیعی مغز منجر شود(47-39). با این وجود، بهدلیل اثرات فیزیولوژیک امگا3 برای سلامت مادران باردار و نوزادان استفاده از آن توصیه میشود(48). امروزه به دلیل اثرات امگا3، حتی در پی ارائۀ مقادیر بالای آن با استفاده از مدلهای تراژنی (ترانسژنیک)، و مستقل از رژیم غذایی مادر هستند(49). براساس پژوهشهای انجام شده، مقدار مناسب اسید چرب DHA، بهعنوان مهمترین مکمل از خانوادۀ امگا3 برای زنان باردار، حداقل 200 میلیگرم در روز است(50).
سیستم عصبی و مغز
DHA نقش مهمی در سیستم عصبی دارد، بهطوریکه تغییرات آن آثار مهمی، بهویژه بر مغز و شبکیه، میگذارد و به تغییرات عصبی در آنها منجر میشود. این تغییرات علاوه بر اثرگذاری بر بینایی و مغز، آسیبهایی را نیز به حس بویایی وارد میکند(6). بهعلاوه، کاهش عملکرد یادگیری، حافظۀ فضایی و متأثر شدن شناخت تنها تعدادی از این تأثیرات در مطالعات حیوانی است(8). DHA بهعنوان یک مولکول فعال شناخته میشود و نقش آن بهمثابۀ فسفولیپیدها در تنظیم سیگنالینگ G پروتئین، مشخص شده است(51). در سطح زیستی سلول، DHA در مدل مرگ سلولی با اثرگذاری در افزایش فسفاتیدیلسرین (phosphatidylserine: PS) نقش محافظتی دارد. بدین ترتیب کمبود DHA نیز منجر به کاهش PS میشود و بهدلیل همین اثر، DHA نقش مهمی در تنظیم سیگنالینگ سلولی، انتقالدهندههای عصبی، تکثیر سلولی(51)، حفاظت در برابر استرس اکسیداتیو و تکامل سیستم عصبی را بر عهده دارد(52). این عملکرد وابسته به نقش DHA درون غشای عصبی آبگریز است(52).
DHA مقدار قابل توجهی از حجم مغز را شکل میدهد و اهمیت زیادی در رشد مغز دارد. نورونها در سیستم عصبی دائم درحال ساخت اتصالات دندریتی و آکسونی بههمراه غشای سلولی هستند. غشای درحال رشد نسبتاً مایع بوده و DHA مهمترین عنصر در مایعسازی غشایی است. حتی سیناپسهایی که واحد عملکردی اولیۀ مسیرهای مغزی را شکل میدهند، از غشاهایی ساخته شدهاند که بهمیزان زیادی غنی از DHA هستند. شبکیه، که عملاً انشعابی از مغز است، از سلولهای مخروطی و استوانهای ساخته شده است که بیشترین غشاهای مایع را در سلولهای بدن شامل میشود و نقش DHA در آن بارز است(53). در حقیقت DHA در کنار AA عمدتاً در مغز یافت میشود و بهنظر میرسد برای رشد مغز ضروری باشد(54). همچنین اسیدهای چرب امگا3 منشأ سوختوساز بدن برای رشد و نمو مغز محسوب میشوند. نسبت بالای DHA در مغز بهعنوان اتانولآمینفسفوگلیسرید (ethanolamine phosphoglycerides: EPG)، اتانولآمینپلاسمولوژن (ethanolamine plasmologen) و فسفاتیدیلاتانولآمین (phosphatidylethanolamine: PE) و PS و شرکت بالای 35 درصدی از اسیدهای چرب در غشاهای پلاسمایی سیناپسی، بهعنوان ویژگی بارز پستانداران، بدون در نظر گرفتن غلظت پایین DHA در پلاسما و چربیهای کبدی است(52). پژوهشهای زیادی دربارۀ تکامل عصبی، جبران ترکیبات لیپیدی و تأثیرگذاری مقادیر مناسب امگا3 بر رشد مغز صورت پذیرفته است، ازجمله مطالعۀ McCann و Ames (2005) دربارۀ اهمیت و اثر DHA بهعنوان اسید چرب اشباعنشده با زنجیرۀ بلند برای رشد هنجار مغز، نشاندهندۀ مصرف ناچیز ماهی و غذاهای دریایی در دوران بارداری است که منجر به کاهش بهره هوشی (IQ) و اختلال رشد سیستم عصبی میشود و حتی از آن بهعنوان عامل مؤثری در بروز اسکیزوفرنی در دوران بزرگسالی یاد میکنند(27). نقص یادگیری، کاهش وزن مغز، تغییر ترکیبات اسید چرب اعصاب(58-55)، تأثیر بر خواب(59)، اختلالات حافظه با تأثیر بر دانسیتۀ گیرندههای هیپوکامپ و متابولیسم انتقالدهندههای عصبی(60)، کاهش مهارتهای کلامی(61و62)، تأثیر بر رفتار از طریق کاهش سطح سروتونین در دورۀ بحرانی نمو عصبی و در نهایت رشد نامناسب و ناکافی سیستمهای انتقالدهندۀ عصبی، محدودیت تنظیم سیستم لیمبیک توسط قشر پیشانی و عدم کنترل رفتاری از آسیبهای ناشی از نقص یا سوء مصرف امگا3 است(63).
پژوهشهای انجامشده نشان میدهد رژیمهای غذایی با مقادیر متفاوت امگا3 و امگا6 ممکن است با ایجاد تغییر در گلیالاسید یک پروتئین و پروتئینهای پایهای میلین بهعنوان تابعی از مقادیر این اسیدهای چرب باعث تغییرات بافتی مغزی شود. نتایج تحقیقات نشان میدهد که فزونی مصرف مقادیر امگا3 با نسبت پایین امگا6 به امگا3 در حدود یک به یک تا دو در طول دوران بارداری و شیردهی مادر ممکن است بر رشد مغزی نوزاد مؤثر باشد(64). در مطالعات حیوانی، مصرف امگا3 و بهویژه DHA در قالب مکملهای غذایی در دوران بارداری و شیرخوارگی(65) و نیز برای جبران نقص وارده پس از تولد(66) حتی در نسلهای بعدی نوزادان متولدشده از مادران با نقص امگا3 مورد توجه قرار گرفته است(67). نتایج نشاندهندۀ وجود نقص در نسلهای بعدی و جبران سطح DHA با استفاده از مکملهای امگا3 در مغز و سرم خون بود(66و67). با وجود این، اشاره میشود که زمان استفاده از رژیمهای غذایی امگا3 بهعنوان مداخله، ارتباط مستقیمی با جبران نقص عصبی وارده دارد؛ بهطوریکه مصرف این مکملها از زمان لقاح میتواند اثرات نقص به وجود آمده را در نسل دوم جبران کند، درحالیکه مصرف آن تنها در اواخر دوران حاملگی شکاف بزرگی را در تکامل به وجود خواهد آورد(67). پژوهشهای حیوانی انجامشده توسط Kimura و همکاران (2005 و 2011) برای جبران نقص و بهبود سطح DHA بافتی در دوران شیرخوارگی نیز نشاندهندۀ موفقیت در جبران نقص عصبی وارد شده است(68-65). مطالعات انسانی انجام شده نیز مؤید نتایج بهدستآمده از پژوهشهای حیوانی است. از جمله، پژوهشی که توسط Voigt و همکاران (2002) با عنوان بررسی ارتباط بین وضعیت اسیدهای چرب اشباعنشده با زنجیرۀ بلند در دوران نوزادی و تکامل عصبی آنها در یکسالگی پساز تولد بهمنظور تعیین تأثیر مصرف چهار میزان متفاوت آلفاـلینولئیک اسید (14/0، 7/1 و 2/3 درصد از کل اسیدهای چرب) بر تکامل عصبی با 3 ابزار سنجش Bayley برای رشد نوزادان انجام شد و نتایج نشاندهندۀ ارتباط معنیدار بین متغیرهای مورد پژوهش و مؤید آن بود که میزان اسیدهای چرب امگا3 میتواند در تکامل عصبی در سن یکسالگی نوزاد مؤثر باشد(69). مصرف DHA بر رشد نوزادان نارس نیز اثرگذار است. با اینوجود، تعیین تأثیرات DHA تخمین زده شده روی رشد عصبی نوزادان نارس در 18ماهگی با استفاده از Bayley Mental Development Index: MDI)) نشان میدهد دوز یک درصد از DHA نسبت به کل اسیدهای چرب، امتیاز MDI را در نوزادان نارسی که زودتر از 33 هفتگی به دنیا آمدهاند را افزایش نمیدهد(70). با وجود آنکه دوزهای مناسب امگا3 اثر ترمیمی بر غشاهای سلولی، سیستم ایمنی و رشد جنین دارد، نقص مصرف و افزایش بیرویۀ امگا3 و بهویژه DHA ممکن است بر مکانیسمهای مذکور اثر منفی گذارد. برای مثال، مطالعات محققان بیانگر آن است که مغز در اثر مصرف بیرویۀ این اسید چرب ضروری آسیبپذیر میشود، چرا که این امر باعث کاهش نسبت امگا6 به امگا3 میشود و آنزیم مخرب دزاتوراز را افزایش میدهد و باعث اختلال در فعالیتهای مغزی میشود که قابل جبران نیست(71). اختلالات ناشی از مصرف بالای اسیدهای چرب، چنانچه محدود به یک دورۀ زمانی کوتاه باشد، پساز مدتی با مکانیزمهای جبران مرکزی جبران میشوند؛ لیکن در مصرف طولانیمدت، اختلالات انعقادی خون و نقص متابولیک بروز میکند که مکانیسمهای جبرانی برای جبران آنها کارایی ندارد(71). بنابراین بهنظر میرسد استفادۀ متعادل و بهموقع از اسیدهای چرب امگا3 و امگا6 بدون استفاده از اسیدهای چرب با زنجیرۀ بلند، باعث بلوغ کافی و سریع سیستم عصبی مرکزی میشود(72).
مکانیزمهای تأثیرگذاری بر سیستم عصبی
تفاوت در عملکردهای عصبی سیستمهای بینایی، شنوایی و یادگیری نوزادان و حیوانات با رژیمهای غذایی متفاوت از نظر اسیدهای چرب امگا3 گزارش شده است. اما اساس عصبی بیوشیمی این تغییرات نامشخص است. در مطالعۀ de la Presa Owens و Innis (2000) اثرات رژیم غذایی امگا3 و امگا6 با مقادیر کافی و ناکافی امگا3 بر انتقالدهندههای عصبی در مناطق مختلف مغز در سطح حیوانی بررسی شد. مقادیر امگا3 و امگا6 در رژیم غذایی اثرات معنیداری بر میزان دوپامین قشر پیشانی، 3,4 دهیدروکسی فنیلاستیک اسید (3,4-dihydroxyphenylacetic acid)، هومووانیلیک اسید homovanillic acid))، سروتونین، 5ـ هیدروکسی ایندولاستیک اسید (5-hydroxyindolacetic acid)، سروتونین برجستگی تحتانی (inferior colliculus: IC) و جسم مخطط (striatum) داشت که منجر به غلظت کمتر آنها در حیوانات با رژیم غذایی ناکافی امگا3 شده بود. استفاده از DHA و AA در رژیم غذایی ناکافی امگا3 و امگا6 منجر به افزایش غلظت تمامی منوآمینها در قشر پیشانی، سروتونین جسم مخطط و برجستگی تحتانی میشود. استفاده از DHA و AA در رژیم غذایی، موجب افزایش دوپامین و 5ـ هیدروکسیایندولاستیک اسید در برجستگی تحتانی و فوقانی، نواحی وابسته به پردازش و ادغام اطلاعات بینایی و شنوایی میشود. این مطالعه نشان میدهد که تغییرات عملکردی بین حیوانات و نوزادانی که از رژیم غذایی متفاوت از نظر اسید چرب امگا3 استفاده میکنند، وجود دارد. همچنین امگا3 متابولیسم انتقالدهندههای عصبی را نیز تغییر میدهد(60).
سیستم شنوایی
همانطور که
در قسمتهای
قبل عنوان شد مصرف امگا3
و بهویژه DHA
میتواند موجب
افزایش
امتیازها در
آزمونهای
رشد و نمو
عصبی شود که
نشاندهندۀ
دخالت این
اسید چرب در
مکانیزم
مذکور است.
مطالعات بیشماری
اثرگذاری این
عامل بر رشد
سیستم عصبی را
در قالب بررسی
تغییرات
بافتی
اسیدهای چرب مغز،
پلاسما و
گلبولهای
قرمز،
پتانسیلهای
برانگیختۀ
بینایی و
همچنین
پتانسیلهای
برانگیختۀ
شنوایی مورد
بررسی قرار
دادند(73).
پتانسیلهای
برانگیختۀ
شنوایی ساقۀ
مغز (Auditory Brainstem Response: ABR)
شامل پتانسیلهای
کوچکی است که
از ساختارهای
شنوایی ساقۀ
مغز نسبت به صدا
ایجاد میشوند و در میان
سایر پاسخهای
برانگیختۀ
شنوایی بهدلیل
اعتبار و ثبات
بالا و شباهت
بسیار زیاد آن
در بین افراد
مختلف پاسخهای
منحصر به فردی
محسوب میشوند.
این ویژگیها
موجب کاربرد
بالای آزمون
پاسخهای
شنوایی ساقۀ
مغز هم در
حیطۀ
نورواتولوژیک
و هم تخمین
آستانۀ
شنوایی شده است. امواج
مشاهده شده
در آزمون پاسخهای
برانگیختۀ
شنوایی ساقۀ
مغز از سطوح
مختلف عصب و
ساقۀ مغز نشأت
میگیرند. ABR در کشف
ضایعات ورای
حلزونی یعنی
آسیب عصب هشتم
مغزی و ساختارهای
شنوایی ساقۀ
مغز ابزار
مفید و حساسی
محسوب میشود.
اساس طبیعی
بودن نتایج
این آزمون،
طبیعی بودن
راههای
شنوایی از عصب
تا ساقۀ مغز و
بهبیانی
دیگر هنجار
بودن تمامی
اجزا و
مکانیزمهای
درگیر مانند
نورونها
و ساختار
سلولی،
سیناپس بین
سلولهای
عصبی،
انتقالدهندههای
عصبی در مسیر
مذکور و
یکپارچگی آنها
است؛ به طوری
که هدف اولیه از
انجام ABR بهعنوان
ابزار تشخیصی
را بررسی
یکپارچگی عملکردی
سیستم عصبی
شنوایی در این
سطوح ذکر میکنند(75-73).
محققان بر این
باورند که ABR ابزار
مهمی در اندازهگیری
حساس مغز و
رشد حسی و
عملکردی
محسوب میشود و
بههمیندلیل
اکثر تحقیقات
انجام شده در
حیطۀ شنوایی
با بهرهگیری
از ABR صورت پذیرفته است(42،76و77). همچنین
با توجه به
این که زمان
انتقال عصبی
ساقۀ مغز
تخمین اولیهای
از درجۀ
میلینهشدن
راههای
عصبی است و
رژیم دارای
چربی میتواند
رشد و توسعه
میلین را در
دورۀ بعد از
شیرخوارگی
نشان دهد، ABR
بهعنوان ابزاری
برای اندازهگیری
مناسب
میلینه شدن
مسیرهای
شنوایی در نظر گرفته
میشود و میتوان
از آن برای
بررسی نقش
اسیدهای چرب
امگا3 در نمو
عصبی جنین
بهره گرفت(10). دربارۀ
این موضوع
تحقیقات در دو
فاز انسانی و
حیوانی صورت پذیرفته است.
سرآغاز
مطالعات
انسانی در
بازۀ زمانی
مورد بررسی در
این حوزه دو
مطالعۀ Murata و
همکاران (1999) است
که در آن
گزارش کردند
کودکانی که
مادران آنها
مقادیر زیادی
غذاهای
دریایی مصرف کرده بودند،
افزایش زمان
نهفتگیهای
امواج ABR (بهویژه
زمان نهفتگی
قلۀ III) نشان میدهند
که نشاندهندۀ
تأخیر در بلوغ
عصبی یا نقص
دائمی عصبی
است؛ هرچند
نویسندگان
این مقالات در
ادامۀ مقالات
در حوزههای
دیگر معتقد
بودند نتایج
منفی ABR بهعلت
ترکیبات آلی
جیوه موجود در
غذاهای دریایی
بوده است.
این درحالیاست
که احتمال
اثرات مخرب
ایجاد شده
در نتیجۀ مصرف
مقادیر فراوان
امگا3 در آنها
نادیده گرفته شده
است(78و79). در همین
سال Bougle و همکاران
(1999) در کنار
آزمایشهای
خود با ABR به
بررسی بلوغ
عصبی نوزادان
نارس با سه
رژیم غذایی
حاوی امگا3
پرداختند و تفاوت
معنیداری
بین
پارامترهای
پتانسیلهای
برانگیخته
نیافتند(72). Voigt و
همکاران در
سال 2002 وضعیت
اثرگذاری
اسیدهای چرب
اشباعنشده با
زنجیرۀ بلند
در دوران
نوزادی و
همچنین وضعیت
عصبی آن
نوزادان در یکسالگی
پس
از
تولد را با سه
ابزار که یکی از
آنها
شاخص کلینیکی
مراحل
شنیداری و
زبانشناختی (Clinical
Adaptive Test/Clinical Linguistic and Auditory Milestone Scale: CAT/CLAMS) بود
بررسی کردند
که نتایج نشان
داد میزان
اسیدهای چرب
امگا3 در طول
دوران نوزادی
میتواند
در تکامل عصبی
در سن یکسالگی
نوزاد مؤثر
باشد(69). Parra-Cabrera و
همکاران در
سال 2008 مطالعهای
را دربارۀ
تأثیر مصرف
امگا3 توسط
مادر بر ABR
نوزادان
مکزیکی انجام دادند
که در آن مصرف
اسید آراشیدونیک،
بهعنوان
ترکیبی از
خانوادۀ
امگا6، با
کاهش زمان
نهفتگی امواج ABR
همراه بود؛
اما مصرف DHA
تأثیر
معنیداری بر
این امواج
نداشت(80). Gopinath و
همکاران (2010)
ارتباط بین مصرف
امگا 3 (ماهی) و ریسک کمشنوایی
وابسته به
سن را بررسی
کردند که
همبستگی
معکوس بین مصرف
بالاتر امگا3
و ماهی بهطور
منظم در هفته
و کمشنوایی
وابسته به
سن نشان داد؛
بهطوریکه
مداخلۀ رژیم
غذایی با N3-PUFAs
میتوانست
منجر به
پیشگیری یا بهتأخیر
انداختن
توسعه کمشنوایی
وابسته به سن شود(81).
همچنین
مطالعۀ stein و
همکاران (2012) در
بررسی اثر
مکمل امگا3
توسط مادر بر ABR
نوزادان
مکزیکی در یک
و سه ماهگی،
نشاندهندۀ
عدم اثرگذاری
استفاده از DHA
بر نتایج ABR
بود؛ هرچند
این مداخله از
هفتۀ 22-18
بارداری آغاز
شده بود(82).
در این زمینه
نتایج
مطالعات
انسانی انجامشده
یکدیگر را
تأیید نمیکنند،
اما در حوزۀ
حیوانی پژوهشهای
صورت گرفته
همسویی
بالایی بین
نتایج وجود
دارد. Saste و همکاران
(1998) تأثیر ترکیب
اسیدهای چرب
رژیم غذایی
مادر بر رشد
عصبی نوزادان
موشهای
صحرایی را بهصورت
ارزیابی
رفلکس
استارتل و ABR
بررسی کردند
که نتایج آن
نشان داد زمان
انتقال عصبی
در ABR و رفلکس
شنوایی
استارتل
نوزادان موشهای
گروهی که از
رژیم غذایی
روغن ماهی
بهره میبردند
بیشتر است.
آنالیز ترکیب
اسیدهای
چرب شیر موش
صحرایی مادر و
مغز نوزادان نیز
سطوح بالاتر
امگا3 و امگا6
را در گروه با
رژیم روغن
ماهی نشان میداد. Salvati و همکاران (1993 و
1996) گزارشکردند
که کل ترکیبات
مغز موشهای
صحرایی که از
مکملهای
روغن ماهی
استفاده کرده بودند سطح
پایینتری از
پروتئین پایهای
میلین و
فعالیت کمتری
از 2′ـ3′ سیکلیک
نوکلئوتید 3′ـ فسفودی
استراز (2′-3′-3
cyclic nucleotide ′phosphodiesterase: CNPase)،
که بهعنوان
آنزیم شاخص
میلینسازی
شناخته میشود،
نشان میدهد(83و84). آنها
معتقد بودند
که کاهش
فعالیت آنزیم
ممکن
است بهعلت
تأخیر در رسوب
میلین و یا بیثباتی
در ساختار
میلین باشد.
همچنین
افزایش زمان
تأخیر رفلکس
استارتل
شنوایی نیز که
شامل الیاف آوران
حلزون و نورونهای
هستۀ حلزونی
است(85)، به
اختلالات
میلینی و سیناپسی
موجود در این
چرخه نسبت
داده شد(86). Bourre و همکاران
(1999) با بررسی اثر
نقص آلفاـلینولنیک
اسید بر ABR
در چند گروه
سنی نشان
دادند که
دامنه و زمان نهفتگی
امواج ABR (بهویژه
موج III) بهطور
پیشروندهای
در گروه با
رژیم نقص
امگا3 سریعتر
از گروه هنجار
افزایش مییابد
و این نشاندهندۀ
آن
است که این نقص
میتواند
منجر به عدم
بلوغ
عصبی یا پیری
زودرس سیستم
شنوایی شود(87).
در
بررسی تأثیر
دوزهای
مختلف امگا3 Stockard و
همکاران (2000) بهطور
خاص اثر سه
دوز از مکمل DHA (2، 4 و 6
درصد از کل
اسیدهای
چرب) بر
نوزادان موشهای
صحرایی را در
طول بارداری و
شیردهی
مادران با
استفاده از ABR سنجیدند
که در آن مشخص شد
رابطۀ منفی
میان دوز
استفاده شده و ABR
وجود دارد. این
نتایج با
آنالیز DHA و AA
بافت مغزی
مطابقت داشت .در
این مطالعه با
تعیین دقیق
مقادیر DHA
مصرفی مشخص
شد که تنها
سطوح بالای DHA
میتواند اثر
سوء بر رشد
سیستم عصبی
داشته باشد(88). Haubner
و همکاران (2002)
اثر تغذیۀ
مادر با سه
دوز دیگر از DHA
(3،1، و صفر درصد
از کل اسیدهای
چرب) بر بروز
رفلکس
استارتل
شنوایی، زمان
انتقال عصبی و
فعالیت CNPase
در
هموژنز ساقۀ
مغز در
نوزادان موشهای
صحرایی را
بررسی کردند.
نتایج نشان
داد که گروه 3 درصد
رفلکس
استارتل
دیرتری نسبت به
گروه صفر درصد
دارد؛ هرچند
سطح بیان CNPase
بین این دو گروه
تفاوت
معنیداری
نداشت. طی
این مطالعه
مشخص شد رژیم
غذایی غنی از DHA بر رشد و
تکامل CNS
اثر سوء دارد
و این اثر
عمدتاً از
طریق اثرات ایجاد
شده بر میلین
رخ میدهد(43). Auestad و همکاران
(2003) متفاوت از
تحقیقات
پیشین تنها به بررسی
اثرات رژیم
غذایی با
مقادیر بالای DHA
با استفاده از ABR
در دوران
شیرخوارگی
(بعد از
تولد) و بررسیهای
بافتی
پرداختند.
برخلاف
مطالعات قبلی
که در آنها
زمان نهفتگیهای
طولانی موشهای
صحرایی
نوجوان حاصل از مادران
با تغذیۀ
بالای DHA در طول
دورۀ بارداری
و شیردهی دیده
شد، نتایج این
مطالعه زمان
نهفتگی کمتر ABR
را در
نوجوانان
تغذیه کننده
از رژیم غذایی
سرشار از DHA
تنها بعد از
تولد نسبت به
دریافتکنندگان
ترکیب DHA و AA نشان
میداد.
همچنین سطح
نورو اپی
نفرین IC در این
گروه پایینتر
از گروه
دریافتکنندۀ
DHA+AA
بود(89). از میان
منوآمینهای
انتقالدهندۀ
عصبی
(سروتونین،
دوپامین و
نورواپینفرین)
که در پردازش
شنوایی مرکزی
نقش ایفا میکنند
و توزیع
متفاوتی در
مسیرهای
شنوایی دارند
نورواپینفرین
عموماً در
پردازش
اطلاعات
شنوایی دخالت
اولیه دارد(90).
از میان
منوآمینهای
مورد بررسی در
این پژوهش
تنها سطوح
نورواپینفرین
در IC موشهای
صحرایی تغذیهکننده
از رژیم با DHA
بالا کمتر از مقادیر
هنجار بود.
افزایش سطح
نوراپینفرین
همراه با ABR
با زمان
نهفتگی
طولانیتر
میتواند نشاندهندۀ
درگیری
نوراپینفرین
در سطح IC باشد(91).
این مطالعه
نشان میدهد
که ABR ممکن است
به رژیمهایی
که منجر به
تغییر نوراپینفرین
در IC شود، حساس
باشد(89). Haubner و
همکاران بار
دیگر در سال 2007
تأثیر دوزهای
دیگری از DHA
(صفر، 3/0 ، 7/0 یا 3
درصد از کل
اسیدهای
چرب) را بر
رفلکس
استارتل
شنوایی و
ترکیب میلین
مغزی بررسی
کردند و نتیجه
گرفتند که سطوح
بالای مصرف DHA
توسط مادر،
ترکیب لیپیدی
میلین نوزاد
موشهای
صحرایی را
تغییر میدهد
و این همراه
با زمان
نهفتگی
طولانیتر
پاسخهای
استارتل میتواند
پاسخهای
الکتروفیزیولوژیک
وابسته به
میلین باشد(14).
در نهایت Church و
همکاران از
سال 2007 آغازگر
روند
مطالعاتی جدید
در این حیطه
بودند که تا
کنون ادامه
دارد. آنها
دریافتند که
مصرف بالای
روغن ماهی
توسط مادران
موشهای صحرایی
در طول
بارداری و
شیردهی موجب
افزایش
آستانههای ABR
در کودکان آنها
میشود.
این اثر بهطور
بارز در
فرکانسهای 2، 4
و 16 کیلوهرتز
دیده شد اما در
فرکانس 8
کیلوهرتز
وجود نداشت.
همچنین شکل
ضعیف امواج در
گروه با مصرف
بالای روغن
ماهی مشهود
بود. ناهنجاریهای
دیده شده در
موجهای II، III و IV مشهود بود.
یافتههای
آستانه و شکل
موج امواج ABR
نشاندهندۀ
شنوایی
ناهنجار و
اختلالات
عصبی برای نوزادان
در شرایط
فزونی مصرف
است. نتایج
این تحقیق
نشان میدهد
که فزونی مصرف
منجر به افزایش
زمان نهفتگی،
زمان انتقال
عصبی طولانی،
کمشنوایی
حسیعصبی و
مورفولوژی
ضعیف امواج ABR
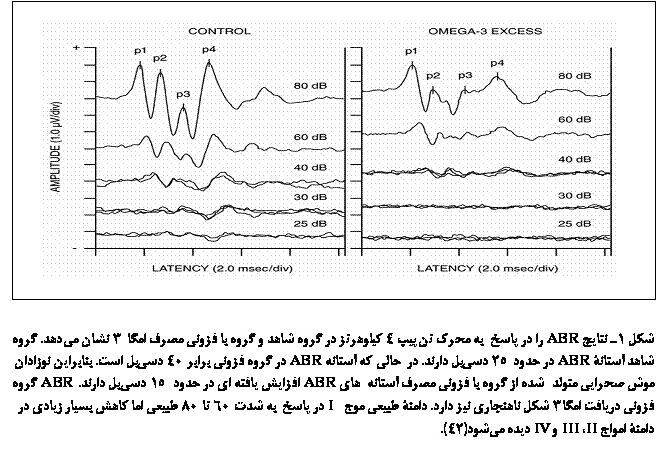
میشود(شکل
1). همچنین نقص
در مصرف
امگا3، همانطورکه
بیان شد، برای
رشد سیستم
عصبی اثرات
مخربی بههمراه
خواهد داشت،
هرچند در بعضی
از
این تحقیقات
اثرات مخرب
فزونی مصرف
بیشتر از نقص
مصرف آن بوده
است(42). این
مطالعات در
سالهای
2008،