Research
Article
Cognitive
disorders in patients with insulin-dependent type I diabetes mellitus
Parisa
Jalilzadeh afshari1, Ghassem Mohamadkhani1,
Nematollah Rouhbakhsh1, Shohreh Jalaie2, Ensieh Nasli
Esfahani3
1- Department of Audiology, School
of Rehabilitation, Tehran University of Medical Sciences, Iran
2- Department of Biostatistics, School
of Rehabilitation, Tehran University of Medical Sciences, Iran
3- Endocrinology and Metabolism
Research Institute, Tehran University of Medical Sciences, Iran
Received: 19 February 2012, accepted: 14 August 2012
Abstract
Background and Aim:
Diabetes mellitus is a common disorder and causes a variety of central nervous
system complications such as cognitive deficits. P300 auditory event related
potential application is a well established neurophysiological approach in the
assessment of cognitive performance. In this study, we compared the results of
this application in patients with insulin-dependent (type I) diabetics mellitus
and normal individuals.
Methods: In this
non-interventional study, auditory P300 was measured in oddball paradigm by using
two tone burst stimuli (1000 and 2000 Hz) on 25 patients with type I diabetics
mellitus with the mean age of 28.76 years and 25 age-, education- and
sex-matched healthy controls with the mean age of 29.68 years. The participants
were enrolled by probable and category random sampling style.
Results:
The mean P300 latency of the patients with type I diabetes mellitus was
significantly prolonged compared with that of normal controls at all electrode
sites and in both genders (p<0.001). The mean P300 amplitude of these
patients was significantly lower compared with that of normal controls at all
electrode sites and in both genders (p<0.001).
Conclusion:
Significant prolongation in P300 latency of the patients with type I diabetes
mellitus shows that auditory information processing and information
categorizing are slower in them. Significant reduction in P300 amplitude of the
patients with type I diabetes mellitus demonstrates that working memory in
these patients cannot recognize new events and update its context in accordance
with them.
Keywords:
Auditory event-related potential, amplitude, latency, type I diabetes mellitus
مقاله
پژوهشی
بررسی اختلالات شناختی در افراد مبتلا به دیابت نوع
یک با استفاده از پتانسیلهای وابسته به رخداد
شنوایی
پریسا جلیلزاده
افشاری1، قاسم محمدخانی1، نعمتاله روحبخش1، شهره
جلایی2، انسیه نسلی اصفهانی3
1ـ گروه شنواییشناسی،
دانشکده
توانبخشی، دانشگاه علوم پزشکی تهران، ایران
2ـ گروه آمار
زیستی، دانشکده توانبخشی، دانشگاه علوم پزشکی تهران،
ایران
3ـ مرکز تحقیفات
غدد و متابولیسم، دانشگاه علوم پزشکی تهران، ایران
چکیده
زمینه
و هدف:
دیابت شیرین اختلال شایعی است که میتواند
درگیریهای گوناگونی از جمله نقائص شناختی در
سیستم عصبی مرکزی ایجاد کند. کاربرد پتانسیل وابسته
به رخداد P300 بهعنوان یک رویکرد نوروفیزیولوژیک
در ارزیابی عملکردهای شناختی به خوبی مشخص شده است.
در این مطالعه پتانسیل وابسته به رخداد P300
شنوایی در افراد هنجار و مبتلا به دیابت نوع I مقایسه شده است.
روش
بررسی: در این مطالعه
غیرمداخلهای، پتانسیل P300 شنوایی به روش
الگوی تحریک متفاوت با استفاده از دو محرک تنبرست 1000 و 2000 هرتز
روی 25 فرد مبتلا به دیابت نوع I با
میانگین سنی 76/28 سال و 25 فرد هنجار با میانگین
سنی 68/29 سال و شرایط سنی، جنسی و سطح تحصیلات
مشابه انجام شد. از روش نمونهگیری از نوع احتمالی و
تصادفی طبقهای استفاده شد.
یافتهها: میانگین
زمان نهفتگی P300 در بیماران بهطور معنیداری در
مقایسه با افراد هنجار در هر دو جایگاه الکترودی و دو جنس
افزایش(000/0=p) نشان داد
و میانگین دامنۀ P300 در
هر دو جنس بیماران نسبت به افراد هنجار در هر دو جایگاه
الکترودی باشد کاهش معنیداری(000/0=p) داشت.
نتیجهگیری: افزایش معنیدار
زمان نهفتگي در بیماران نشانۀ پردازش اطلاعات شنوايي کندتر و سرعت طبقهبندي
اطلاعات کمتر بود. کاهش معنیدار دامنۀ موج P300 در
بیماران بیان میکند که حافظۀ کاری نمیتواند
به خوبی رخداد جدید را شناسایی کرده و محیط خود را
برحسب آن بههنگام کند.
واژگان
کلیدی: پتانسیل وابسته به رخداد شنوایی، دیابت
شیرین نوع I، دامنه، زمان نهفتگی
(دریافت مقاله: 30/11/90، پذیرش: 24/5/91)
مقدمه
دیابت شیرین
نوعی اختلال مزمن در متابولیسم کربوهیدراتهاست که
میتواند منجر به نقص و کمبود نسبی یا کامل انسولین در
بدن شود. عموماً در بدن بیماران مبتلا به دیابت نوع یک
آنتیبادیهای انسولین مشاهده میشود که
میتوانند سلولهای بتای پانکراس را تخریب کنند و
این پدیده نشاندهندۀ ماهیت خودایمنی
این بیماری است(1). در ابتلای طولانیمدت به
دیابت شیرین ممکن است اختلالاتی در چشمها،
کلیهها، اعصاب جمجمهای، اعصاب محیطی و گوشها رخ دهد.
این بیماری همچنین میتواند باعث ایجاد
اختلالات و درگیریهای اولیه و ثانویه در
سیستم عصبی مرکزی (Central Auditory System: CNS) و سطوح بالاتر آن یعنی عملکرد و
فرایندهای شناختی شود. اثرات اولیۀ دیابت بر CNS
میتواند به دنبال هیپرگلیسمی یا عملکرد
آسیبدیدۀ انسولین و یا هر دو رخ دهد، درحالی
که اثرات ثانویه، ناشی از اختلالات عروقی دیابتی
یا درمان بیش از حد با انسولین و به عبارت بهتر آسیب
مغزی ناشی از حملات هیپوگلیسمی هستند(2و3).
برای کسب آگاهی از
فرایند قشری و زیرقشری و ارزیابی صحت و سلامت
عملکردی فعالیتهای شناختی در سطوح بالای CNS،
پتانسیلهای وابسته به رخداد (Event Related
Potentials: ERPs) بسیار مناسباند، چرا که به
نظر میرسد این نوع پتانسیلها روشی مناسب برای
بررسی پدیدههای ناشی از هیپرگلیسمی،
بهویژه در منطقه هیپوکامپ هستند. این پتانسیلها پاسخهای
مغزی همراه با عملکردهای گوناگون شناختی هستند که
میتوانند منعکسکنندۀ چگونگی عملکردهای شناختی
باشند و اطلاعات دقیقی دربارۀ ساختار زمانی الگوهای
فعالیت عصبی قشری فراهم کنند(7-4). از جمله شناخته
شدهترین پتانسیلهای وابسته به رخداد، جزء P300 یا P3 است که
بهعنوان ابزاری مناسب برای ارزیابی اجزای
شناختی بهطور گسترده مورد استفاده قرار میگیرد. روش معمول ثبت
آن روش تحریک متفاوت (oddball paradigm)،
با ارائۀ دو نوع تحریک متفاوت، یکی محرک مکرر یا
استاندارد و دیگری محرک نادر یا هدف است که توجه فرد به محرک
نادر یا هدف باعث تولید موج P300 در زمان نهفتگی
حدود 300 میلیثانیه میشود. P300 با
اندازهگیری دامنه و زمان نهفتگی ارزیابی
میشود. مشخص شده است که دامنۀ P300 مرتبط با
بههنگام درآوری ظرفیت حافظۀ کاری (capacity
updating of the working memory) بوده و زمان نهفتگی P300 مربوط به سرعت
ارزیابی محرک است(4و5). بنابراین دامنۀ کمتر P300 و زمان
نهفتگی طولانیتر P300 میتواند نشاندهندۀ آسیبی در
اجزای وابسته به عملکردهای شناختی باشد(7-4).
مشاهده شده است که در بعضی
از بیماران مبتلا به دیابت تغییراتی در
ساختارهای قشری و زیرقشری و یا در
سیگنالهای مغزی مرتبط با عملکردهای شناختی
ایجاد شده است(2،3و8).
Alvarenga و همکاران (2005) نشان دادند که افراد مبتلا به دیابت نوع یک
تفاوت معنیداری از لحاظ زمان نهفتگی امواج P300 نسبت به
گروه شاهد دارند(8)، در حالیکه Cooray و همکاران (2008) اختلاف
معنیداری از لحاظ زمان نهفتگی امواج P300 افراد
مبتلا به دیابت نوع یک و افراد هنجار مشاهده نکردند(9). از آنجا که
نتایج مطالعاتی که تاکنون برای ارزیابی
تأثیرات دیابت شیرین نوع یک بر
تواناییهای شناختی شنوایی انجام گرفتهاند
یکدیگر را تائید نمیکنند، در این مطالعه دامنه و
زمان نهفتگی پتانسیل وابسته به رخداد P300
شنوایی در افراد مبتلا به دیابت نوع یک و افراد هنجار
مورد بررسی و مقایسه قرار گرفت تا نحوۀ تأثیرگذاری
دیابت بر جنبههای شناختی شنوایی بیشتر آشکار
شود.
روش بررسی
اين پژوهش مقطعی و
غيرمداخلهای روی 25 بیمار مبتلا به دیابت
شیرین نوع یک (13 زن و 12 مرد) در محدودۀ سنی 20 تا
40 سال و با میانگین سنی 76/28 سال بهعنوان گروه مورد و 25 فرد
هنجار (13 زن و 12 مرد) با میانگین سنی 68/29 سال دارای
شرایط سنی و جنسی مشابه بهعنوان گروه شاهد انجام گرفت. روش
نمونهگیری افراد از نوع احتمالی و تصادفی طبقهای
بوده است. معیارهای ورود به مطالعه شامل محدودۀ سنی 20 تا
40 سال، داشتن شنوایی محیطی هنجار (کسب آستانههای
بهتر از 20 دسیبل HL در دو گوش و داشتن تمپاتوگرام نوع An به
معنای فشار گوش میانی در محدودۀ 50+ تا 100-، با
گذردهی هنجار در محدودۀ 3/0 تا 6/1 و حجم مجرای خارجی گوش
در محدودۀ هنجار 9/0 تا 0/2 و وجود رفلکس اکوستیک در محدودۀ
هنجار (بین سطوح شدتی 80 تا 100 دسیبل HL) بهصورت همانطرفی
و دگرطرفی، قرار نداشتن در سیکلهای زمانی خاص، عدم
سابقۀ تشنج، افسردگی، ضربه به سر، کما، محرومیت از خواب و
میگرن، عدم سابقۀ اختلالات ادیولوژیک و اتولوژیک،
عدم استفاده از داروهای مؤثر بر عملکرد CNS از 48 ساعت
قبل و پر کردن فرم رضایتنامه بود. دست برتری از جمله عوامل مؤثر بر
نتایج حاصل از P300 است، بهطوری که افراد چپدست دارای زمان
نهفتگی و دامنۀ کوتاهتر هستند(4) به همین منظور برای
کنترل تأثیرات این عامل بر یافتههای حاصل از پژوهش، تنها
افراد راستدست بررسی شدند. از آنجا که P300 آزمون
شناختی است و ممکن است سطح تحصیلات بر پاسخهای افراد مؤثر
باشد، برای
تعدیل این اثر، افراد با دو سطح
تحصیلی رایج دیپلم و کارشناسی مورد مطالعه قرار
گرفتند. در ابتدا اطلاعاتی از آزمون و نحوۀ انجام آن به افراد مورد مطالعه
ارائه شد. در مرحلۀ بعدی تاریخچهگیری،
ادیومتری تن خالص و ادیومتری ایمیتانس انجام
شد. سپس، محلهای الکترودها با
مادۀ پاککنندۀ تمیز و الکترودهای معکوس روی
ماستوئید دو گوش، الکترودهای غیرمعکوس روی
پیشانی و بخش مرکزی سر و الکترود زمین بین دو ابرو
قرار گرفت. پس از این مراحل، الکترودها به سیستم
اندازهگیریکننده وصل و رسیور داخل گوشی در گوشها قرار
گرفت. در صورتی که امپدانس الکترودها کمتر از پنج کیلو اهم و تفاوت
امپدانس بین الکترودی کمتر از دو کیلو اهم بود، P300 انجام
میشد. برای این منظور از مبدل داخل گوشی و محرک تنبرست
با قطبیت متناوب بهصورت دوگوشی با شدت 75 دسیبل nHL استفاده
شد. روش تحریک متفاوت شامل ارائۀ دو تحریک متفاوت از نظر
فرکانس، محرک استاندارد بهصورت منظم و قابل پیشگویی با فرکانس
1000 هرتز و محرک هدف تصادفی با فرکانس 2000 هرتز بهکار گرفته شد. تعداد کل
تحریکات 200 تحریک (160 محرک استاندارد و 40 محرک هدف) با احتمال وقوع
محرک استاندارد 80 درصد و محرک هدف 20 درصد بوده است. فیلتر مورد استفاده از
نوع باند گذر 1/0 تا 30 هرتز و تعداد تحریک 9/0 در هر ثانیه بود. از
فرد آزمایش شونده خواسته شد که بدون توجه به محرک استاندارد، به هنگام
شنیدن محرک هدف با دست راست خود دکمۀ پاسخ را فشار دهد. در این
مطالعه برای انجام ادیومتری ایمیتانس و رفلکس
اکوستیک از دستگاه اديومتر ايميتانس مدل Zodiac 901 ساخت شركت Madsen
دانمارک و برای انجام ادیومتری تن خالص از دستگاه اديومتر دو
كاناله مدل AC 40 ساخت
شركت Interacoustics دانمارک در اتاقك اكوستيك استفاده شد. آزمایش P300 دستگاه
پتانسیل برانگیختۀ مدل ICS Charter EP ساخت شركت GN Otometric آمریکا ثبت شد.
در تحلیل دادهها
برای آزمون فرضیات ابتدا از آزمون کولموگروفـاسمیرنف
برای بررسی هنجار بودن توزیع دادهها استفاده شد و به علت هنجار
بودن توزیع نمونهها از آزمون آماری t مستقل
استفاده شد.
لازم به ذکر است که روش پژوهش
مطالعۀ حاضر، منطبق با معاهدۀ هلسینکی بوده و توسط
کمیتۀ اخلاق در پژوهش مرکز تحقیقات غدد و متابولیسم
دانشگاه علوم پزشکی تهران با کد E-00137 به تأیید رسیده
است.
یافتهها
در مطالعۀ حاضر
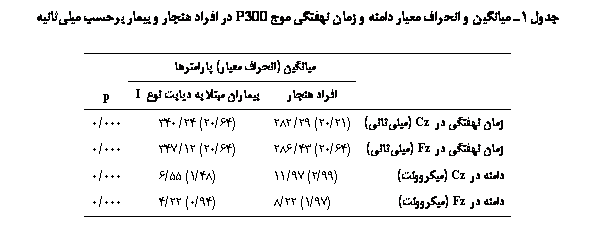
میانگین زمان نهفتگی و دامنۀ موج P300 در هر دو
جایگاه الکترودی Cz و
Fz
بین افراد هنجار و افراد مبتلا به دیابت نوع یک مورد
مقایسه قرار گرفت. یافتههای حاصل از این بررسی
نشان دادند که در هر دو جایگاه الکترودی Cz و Fz بین میانگین
زمان نهفتگی و دامنۀ موج P300 در افراد هنجار و افراد مبتلا تفاوت معنیداری وجود
دارد(000/0=p).
برای حذف اثر جنسیت
بر نتایج، افراد هنجار و بیمار پس از تفکیک به دو جنس نیز
مورد ارزیابی و مقایسه قرار گرفتند و با مقایسۀ
زمان نهفتگی موج P300 به
تفکیک در زنان و مردان هنجار با زنان و مردان بیمار، باز هم تفاوت
معنیدار آماری بین دو گروه هنجار و بیمار مشاهده
شد(000/0=p).
در مرحلۀ بعدی
برای حذف اثر سطح تحصیلات بر یافتهها، افراد هنجار و
بیمار از نظر سطح تحصیلات به دو گروه دیپلم و کارشناسی
تفکیک شدند و نتایج بهدست آمده از مقایسۀ بین
افراد هنجار و بیمار به تفکیک دو سطح تحصیلی نیز
تفاوت معنیدار آماری نشان داد(000/0=p). در جدول 1 نتایج آزمون P300 در افراد
هنجار و بیمار و در شکل 1 نمونهای از شکل موج آنها ارائه شده است.
همانطور که مشاهده میشود، امواج ارائه شده از یک فرد هنجار، از
وضوح و تکرارپدیری بسیار بالاتر و بهتری برخوردارند و
دارای زمان نهفتگی کوتاهتر و دامنۀ بیشتر در مقایسه
با نمونه موج فرد بیمار هستند.
بحث
 در پژوهش حاضر در هر دو
جایگاه الکترودی بین میانگین زمان نهفتگی موج
P300
افراد هنجار و مبتلا تفاوت معنیداری وجود داشت، بهاین گونه که
افراد هنجار در هر دو جایگاه الکترودی میانگین زمان
نهفتگی موج P300 بسیار کمتری در مقایسه با افراد بیمار
نشان دادند. نتایج بهدست آمده از پژوهش حاضر با نتایج مطالعات Riby و همکاران
(2008)، Alvarenga و همکاران (2005) همخوانی دارد (8و10). همچنین در
مطالعهای دیگر توسط Uberall و همکاران (1996) مشخص شد بیماران دارای تفاوت
معنیداری از لحاظ زمان نهفتگی امواج P100-N150-P200 و P300 نسبت به
گروه هنجار هستند، اما تغییری در زمان نهفتگی موج N100
ردیابی نشد(11). این یافتهها با نتیجۀ
مطالعۀ Cooray و همکاران (2008) که P300 و رابطۀ آن با عملکردهای شناختی را در 119
بیمار دارای دیابت نوع یک و 61 فرد هنجار مطالعه کرده
بودند، همخوانی نداشت(9). در مطالعۀ آنها که در محدودۀ
سنی 22 تا 55 سال انجام شده بود از دو فرکانس تحریکی
پایین (900 هرتز) و بالا (1900هرتز) در ارزیابی P300 استفاده
شده بود. روش پاسخگویی افراد نیز به این صورت بود که
آنها باید با شنیدن سیگنال هدف فرکانس پایین،
دکمۀ پاسخگویی در دست چپ و با شنیدن سیگنال هدف
فرکانس بالا، دکمۀ پاسخگویی در دست راست خود را فشار میدادند
(در مطالعۀ آنها نسبت به پژوهش حاضر از تکلیف دشوارتری استفاده
شده بود). آنها افزایش مختصری در زمان نهفتگی P300 گزارش
کردند که از لحاظ آماری معنیدار نبود. به نظر میرسد که علت
این عدم همخوانی بین نتایج ناشی از این باشد
که در مطالعۀ Cooray و همکاران، سرعت پردازش اطلاعات و قدرت تمايز محركها
بهوسيلۀ افراد تحت آزمايش و تفاوت بين افراد بیمار و هنجار با توجه
به تكليف دشوارتر و محدودۀ سنی بالاتر در مقايسه با مطالعۀ حاضر
كاهش یافته است.
در پژوهش حاضر در هر دو
جایگاه الکترودی بین میانگین زمان نهفتگی موج
P300
افراد هنجار و مبتلا تفاوت معنیداری وجود داشت، بهاین گونه که
افراد هنجار در هر دو جایگاه الکترودی میانگین زمان
نهفتگی موج P300 بسیار کمتری در مقایسه با افراد بیمار
نشان دادند. نتایج بهدست آمده از پژوهش حاضر با نتایج مطالعات Riby و همکاران
(2008)، Alvarenga و همکاران (2005) همخوانی دارد (8و10). همچنین در
مطالعهای دیگر توسط Uberall و همکاران (1996) مشخص شد بیماران دارای تفاوت
معنیداری از لحاظ زمان نهفتگی امواج P100-N150-P200 و P300 نسبت به
گروه هنجار هستند، اما تغییری در زمان نهفتگی موج N100
ردیابی نشد(11). این یافتهها با نتیجۀ
مطالعۀ Cooray و همکاران (2008) که P300 و رابطۀ آن با عملکردهای شناختی را در 119
بیمار دارای دیابت نوع یک و 61 فرد هنجار مطالعه کرده
بودند، همخوانی نداشت(9). در مطالعۀ آنها که در محدودۀ
سنی 22 تا 55 سال انجام شده بود از دو فرکانس تحریکی
پایین (900 هرتز) و بالا (1900هرتز) در ارزیابی P300 استفاده
شده بود. روش پاسخگویی افراد نیز به این صورت بود که
آنها باید با شنیدن سیگنال هدف فرکانس پایین،
دکمۀ پاسخگویی در دست چپ و با شنیدن سیگنال هدف
فرکانس بالا، دکمۀ پاسخگویی در دست راست خود را فشار میدادند
(در مطالعۀ آنها نسبت به پژوهش حاضر از تکلیف دشوارتری استفاده
شده بود). آنها افزایش مختصری در زمان نهفتگی P300 گزارش
کردند که از لحاظ آماری معنیدار نبود. به نظر میرسد که علت
این عدم همخوانی بین نتایج ناشی از این باشد
که در مطالعۀ Cooray و همکاران، سرعت پردازش اطلاعات و قدرت تمايز محركها
بهوسيلۀ افراد تحت آزمايش و تفاوت بين افراد بیمار و هنجار با توجه
به تكليف دشوارتر و محدودۀ سنی بالاتر در مقايسه با مطالعۀ حاضر
كاهش یافته است.
تفاوت معنیدار بین
میانگین دامنۀ موج P300 در هر دو جنس افراد هنجار و بیمار بهتفکیک
جایگاه الکترودی، از دیگر نتایج این مطالعه بود که
با نتایج مطالعات Uberall و همکاران (1996) و Riby و همکاران
(2008) همسو بود(11-10). یافتههای فوق با نتیجۀ
مطالعۀ دیگری که توسط Strachan و همکاران (2003) انجام شده
بود همخوانی نداشت(13). در این مطالعه جنبههای
بنیادی و اساسی از عملکردهای شناختی در 15
بیمار مبتلا به دیابت شیرین نوع یک مورد مطالعه
قرار گرفت و دامنۀ موج P300 از پتانسیلهای وابسته به رخداد تفاوت
معنیداری بین افراد هنجار و بیمار نشان نداد. دلیل
اصلی تفاوت بین پژوهش حاضر و مطالعۀ ذکر شده، وجود
فرکانسهای تحریکی متفاوت برای سیگنال هدف بود. در
پژوهش حاضر از سیگنال هدف مرسوم 2000 هرتز برای کسب پاسخ استفاده شده
است، در حالیکه در مطالعۀ Strachan و همکاران (2003)، فرکانس
250 هرتز برای سیگنال هدف بهکارگرفته شده است. پاسخ P300 برای
فرکانسهای بالا در مقایسه با فرکانسهای پایین،
دارای دامنۀ بیشتر و زمان نهفتگی کمتر بوده و استفاده از
سیگنال هدف با فرکانسهای پایین باعث دشواری
فعالیت شده و دامنۀ پاسخ را کاهش و زمان نهفتگی آن را
افزایش میدهد(7-5و12).
یکی از مراکز
اصلی تولیدکنندههای P300 در بافت مغزی، هیپوکامپ
و بهويژه منطقۀ اتصال گیجگاهی/پسسری است كه به
وسيلۀ شبكۀ هيپوكامپ متأثر ميشود(2). شبكه هيپوكامپ نسبت به استرس
بسیار حساس بوده و از لحاظ گیرندههای
گلیکوکورتیکوئید غنی است و شدیداً تحت تأثیر
دیابت قرار میگیرد. دیابت نوع یک با حساسیت
بیش از حد به استرس و افزایش ترشح هورمونهای هیپوتالاموس
همراه است که خود باعث فعالیت بیش از حد محور آدرنال ـ هیپوفیزهیپوتالاموس
شده و منجر به افزایش گردش سطوح بالای
گلیکوکورتیکوئید در خون میشود. به این
ترتیب، دیابت از طریق افزایش گردش سطوح بالای
گلیکوکورتیکوئید در خون، اثرات مخربی بر شبكۀ
هيپوكامپ میگذارد(2و10). کاهش دامنۀ P300 به احتمال
زیاد با اختلال عملکرد عصبی همراه است(3،2و15). فرض بر این است که
نقایص مربوط به هدایت عصبی که در اثر دیابت ایجاد
شده است، منجر به افزایش پراکندگی زمانی در مسیرهای
آوران راههای شنوایی شده و باعث کاهش همزمانی در
فعالیت سلولی سطوح مختلف ساقۀ مغز و قشر مغزی
میشود که پیامد آن کاهش دامنۀ پاسخهای قشری مغز
است. کاهش همزمانی شلیکهای عصبی که شدیداً
دامنۀ پتانسیلهای میدانی تولید شده در قشر
مغز گربهها را کاهش داده است، این فرضیه را تأیید
میکند(3).
دیابت شیرین
اثرات تخریبی دیگری نیز بر مغز دارد. از آن جمله از
طریق استرس اکسیداتیو باعث افزایش Lipofuscin در
سلولهای هیپوکامپ میشود(2). Lipofuscin،
رنگدانهای قهوهای رنگ مشابه ملانین است که در آتروفی
قهوهای در تمام اعضای مختلف بدن و همچنین در سلولهای
عصبی اشخاص مسن یافت میشود و عامل مشخصۀ فرایند
افزایش سن و پروسههای نوروپاتولوژیک است که در بیماران
دیابتی در نتیجۀ استرس اکسیداتیو در
هیپوکامپ تجمع مییابد و پیامد آن آسیب قابل توجه
در یادگیری و حافظه است.
کاهش تولید نورونهای
هیپوکامپ و تجمع Lipofuscin در این نورونها از مشخصههایی است که با
انسفالوپاتی ناشی از سن همراه است که بیانگر این مطلب است
که میتوان مغز دیابتی را همانند مغز سالخورده در نظر گرفت.
کاهش سرعت پردازش بهعنوان مکانیسم پایهای در پی کاهش
توانمندیهای ذهنی و افزایش زمان نهفتگی
پاسخهای مغزی بهدنبال افزایش سن مطرح شده است و همانطور که
بیان شد از آنجا که پروسههای احتمالی دیابت همانند
افزایش سن است، میتوان کاهش توانمندیهای ذهنی و
بهدنبال آن افزایش زمان نهفتگی پاسخهای مغزی را
برای بیماران دیابتی نیز در نظر گرفت(2و3).
از جمله محدودیتهای
علمی این پژوهش میتوان به محدودیت تعداد الکترودها
بهویژه برای کنترل آرتیفکتهای ناشی از حرکات
چشمی و پلکزدن اشاره کرد. آگاهي از اثرات دیابت بر پاسخهای
شناختی در افراد مبتلا به دیابت نوع یک، گسترش مرزهای دانش
شنوايیشناسی در مبحث پتانسیلهای وابسته به رخداد،
ایجاد منابع اطلاعاتی برای افزايش سطح آگاهي بیماران
مبتلا به دیابت، والدين، پزشکان و مراقبین بهداشت و استفاده از يافتههاي
اين پژوهش بهعنوان مبنایی برای طراحي پروتکلهای توانبخشي
بهویژه براي بیماران با سنین کمتر و پايش و
ارزیابی دورهای اثر اقدامات توانبخشي از جمله کاربردهای
این پژوهش است.
نتیجهگیری
در بیماران مبتلا به
دیابت نوع یک بهدلیل از بین رفتن نقش حفاظتی
انسولین در بدن، اختلال در هدایت عصبی رشتههای
صعودی منتهی به قشر مغز، از بین رفتن همزمانی
شلیکهای عصبی و کاهش و عدم تولید مجدد سلولهای
عصبی هیپوکامپ، اطلاعات شنوايي کندتر از افراد هنجار پردازش میشود
و پردازش خودكار و طبقهبندي اطلاعات در این بیماران از سرعت کمتری
برخوردار است. همچنین حافظۀ کاری بیماران مبتلا به
دیابت نوع یک، نمیتواند رخدادهای جدید را بهخوبی
شناسایی کرده و محیط خود را برحسب آن بههنگام کند.
سپاسگزاری
مقاله حاضر برگرفته از
پایاننامه کارشناسی ارشد به شمارۀ 271/260 است. از
کلیۀ بیمارانی که در این طرح شرکت کردند
سپاسگزاریم.
1.
Jameson JL.
Principles of endocrinology. In: Fauci AS, Kasper DL, Longo DL, Braunwald E,
hauser SL, Jameson JL, et al, editors. Principles of Harrison's internal
medicine. 17th ed. New York: Mc Graw Hill; 2008. p. 2187-416.
2.
Alvarez EO,
Beauquis J, Revsin Y, Banzan AM, Roig P, De Nicola AF, et al. Cognitive
dysfunction and hippocampal changes in experimental type 1 diabetes. Behav Brain
Res. 2009;198(1):224-30.
3.
Sima AAF, Kamiya H, Li
ZG. Insulin, C-peptide, hyperglycemia, and central nervous system complications
in diabetes. Eur J Pharmacol. 2004;490(1-3):187-97.
4.
Hall III JW.
New handbook of auditory evoked responses. 2nd ed. Boston: Pearson;
2006.
5.
Polich J.
Updating P300: an integrative theory of P3a and P3b. Clin Neurophysiol.
2007;118(10):2128-48.
6.
Duncan CC,
Barry RJ, Connolly JF, Fischer C, Michie PT, Näätänen R, et al.
Event-related potentials in clinical research: guidelines for eliciting,
recording and quantifying mismatch negativity, P300, and N400. Clin
Neurophysiol. 2009;120(11):1883-908.
7.
Patel SH,
Azzam PN. Characterization of N200 and P300: selected studies of the
event-related potential. Int J Med Sci. 2005;2(4):147-54.
8.
Alvarenga KF,
Duarte JL, Silva DP, Agostinho-Pesse RS, Negrato CA, Costa OA. Cognitive P300
potential in subjects with diabetes mellitus. Braz J Otorhinolaringol.
2005;71(2):202-7.
9.
Shehata G,
Eltayeb A. Cognitive function and event-related potentials in children with
type I diabetes mellitus. J Child Neurol. 2010;25(4):469-74.
10.
Riby LM,
Sunram-Lea SI, Graham C, Foster JK, Cooper T, Moodie C, et al. P3b versus P3a:
an event-related potential investigation of the glucose facilitation effect. J
Psychopharmacol. 2008;22(5):486-92.
11.
Uberall
MA, Renner C, Edl S, Parzinger E, Wenzel D. VEP and ERP
abnormalities in children and adolescents with prepubertal onset of
insulin-dependent diabetes mellitus. Neuropediatrics. 1996;27(2):88-93.
12.
Cooray GK,
Maurex L, Brismar T. Cognitive impairment correlates to low auditory
event-related potential amplitudes in type 1 diabetes. Psyneuen.
2008;33(7):942-50.
13.
Strachan MW,
Ewing FM, Frier BM, McCrimmon RJ, Deary IJ. Effects of acute hypoglycemia on
auditory information processing in adults with Type I diabetes.
Diabetologia. 2003;46(1):97-105.
14.
Hissa MN,
D'Almeida JAC, Cremasco F, de Bruin VMS. Event related P300 potential in NIDDM
patients without cognitive impairment and its relationship with previous
hypoglycemic episodes. Neuro Endocrinol
Lett. 2002;23(3):226-30.
15.
Ziegler D, Hubinger
A, Muhlen H, Gries FA. Effects of previous glycaemic control on the onset and
magnitude of cognitive dysfunction during hypoglycaemia in type 1
(insulin-dependent) diabetic patients.
Diabetologia. 1992;35(9):828-34.

