Research Article
Parisa Rasoulifard1, Ghasem Mohammadkhani1, Saeed Farahani1, Mohammadali Sahraiyan2, Shohreh Jalaie3
1- Department of Audiology, School of Rehabilitation, Tehran University of Medical Sciences, Iran
2- Department of Neurology, School of Medicine, Tehran University of Medical Sciences, Iran
3- Department of Biostatistics, School of Rehabilitation, Tehran University of Medical Sciences, Iran
Received: 6 January 2012, accepted: 1 August 2012
Abstract
Bachground and Aim: The involvement of central auditory nervous system is relatively prevalent in patients suffering from multiple sclerosis (MS). To understand cortex function and to investigate cognitive impairment, event related potential is considered as a valuable tool. This study was aimed to compare the amplitude and latency of the event related potentials of P300 in MS patients and normal individuals.
Methods: This cross sectional study was conducted on 21 MS patients and 27 normal cases aged 18-50 years. Auditory P300 was recorded with oddball paradigm, using two tone burst stimuli (1000 and 2000).
Results: In MS patients, mean latencies were significantly longer (p<0.001) and mean amplitude were significantly lower (p<0.001), in both males and females. Sex did not affect P300 latencies and amplitudes significantly.
Conclusion: MS patients show some degree of event related potential abnormalities. Combination of auditory P300 and neuropsychological tests may be useful to investigate cognitive impairment in MS patients.
Keywords: Multiple sclerosis, event related potential, tone burst stimulation
����� �����ی
����ی �������� �����ی �� ����� ����� �� �Ә���� ����� �� ������� �� �����ی����ی ������ �� ����� ����یی
��ی�� ����ی ���1� ����� �������ی1� ��ی� ������ی1� ������ی ����یی��2� ���� ���یی3
1� ���� ����یی�����ی� ���Ԙ�� �������ی� ���Ԑ�� ���� ��Ԙی ����� �ی���
2� ���� ������ی� ���Ԙ�� ��Ԙی� ���Ԑ�� ���� ��Ԙی ����� �ی���
3� ���� ���� �ی��ی� ���Ԙ�� �������ی� ���Ԑ�� ���� ��Ԙی ����� �ی���
��ی��
��ی�� � ���: �ѐ��� ����� ���� ����� ������ � �������� �����ی �� ����� ����� �� ������ �Ә���� ����� ������ ���� ���. ���ی ��ی �� ���ی�� ����� ���ی� �����ی����ی ������ �� ����� ��ی�� ����� ���. ����� ���� �������� ���ی�ۀ �����ی� ������ �� ����� P300 ����یی �� ����� ����� �� �Ә���� ����� � ����� ����� ����� ����� ���.
��� ����ی: �� ��� ����� ����� P300 ����یی �� ��� ���ی� ������ �� ������� �� �� ��ј ������� 1000 ���� � 2000 ���� �� 21 ��� ����� �� �Ә���� ����� ���� 10 �� � 11 ��� �� �ی��ی� ��ی 8/27 ��� � 27 ��� ����� 15 ��� � 12 �� �� �ی��ی� ��ی 2/23 ��� ��.
ی�������: �ی��ی� ����� �� ����� ����� �� �Ә���� ����� ������ ���ی����ی �捘��� � �ی��ی� ���� ���ʐی ��� P300 ���� ������ ���ی����ی �����ی��� ���. ��ی�� �� ����� � ���� ���ʐی ��� P300 ���ی� �����.
��ی����ی�ی: �ی����� ����� �� �Ә���� ����� �����ی �� �������ی �� �����ی����ی ������ �� ����� ����� � �ی����� �� P300 �������� ی� ����� ������� �� ���� ����� ������ی����ی� �� ����ی �������� �����ی ��� ���� ���� �� �Ә���� ����� ���� ����.
�ǎ��� ��ی�ی: �Ә���� ������ �����ی� ������ �� ����ϡ ��ј �������
(��ی��� �����: 16/10/90� ��ی��: 11/5/91)
�����
������� ����� (Multiple Sclerosis: MS)� �� �펐����� ������ۀ �����ȡ ������������ � ����� (����ѐ����) ���� ������. ���ی�� �ی�ی�����یی ���� �� ����� �������� ��������� �� ����� ������ۀ ����� ���� �����(Central Nervous System: CNS) �������. ��� ����� ���� ������ ������� � �� �� ����� �� CNS ���� ��� ���� ����. ��� ������ ���� ���� � �� ���� �ی���ی���یی �� ������ ��� ����ی ���� ����. �ی� �ی���ی �یѐ������ی ���ǐ��ی ���� �� ی�ی �� ���� ��� ��Ϙ���ۀ �����ی����� (relapsing-remitting) ���. �� �ی� ��ڡ �ی���ی �������� ������� ���� ���� �� �� �ی �� �������� ����� ������� � �� �� ����� ���� ������� �� ��� �� ����� �ی����. �ی� �ی���ی �� ���� ��ی���� �� ����� ��� � �� ��� ���� MRI ������ ��� ����� �ی� �ی���ی ���(1).
�� ���� �� ��� ������ ���� ������ �������� ώ������ ����� �����ϡ ���� ��� �� ����� ������ ��� ���� ������. �������ی���ی ����یی �����ی �� ����� ����� �� MS �ی�� �ی����. ������� ���� ������ �� �ѐ��� ����� ���� ����� ������ (Central Auditory Nervous System: CANS) �� ��� ����� ������ ���� ��ʡ �� ��� �ѐ��� �� ������� �� ������� �� ��������� ������ ����� ����� ���(2). ���ی ��� ��ی �� ���ی�� ����� ���ی � ����ی �������� �����ی� �����ی����ی ������ �� ����� (Event Related Potential: ERPs) ��ی�� ����� ���. ERPs ����یی� ����ی �ی��� ����یی ����� �� �� ���� �������ی ����� ����یی� ������ �� ���������ی �ی�ی�� ����� ���ی� ����یی ����� � �� �� ��� ��ј ����یی� �� ��ј ����� ���� ����� �� ��ј �����ی �ی�ی�� ��� �ی�����. ��� P300 ی� P3 �� ERPs ����یی ��� �� ������ � ��ی�یی ����یی ����. ��� ����� ��� �ی� ���Ρ ��� ���ی� ������ (Oddball) ��� �� �� ����ۀ �� ��� ���ی� ������ ����� �ی����: ی� ��ј ���� ی� ��������� (frequent)� �� ���� �ی��� ����یی (P3a) �� ������� ������ی �� ���� ����ۀ ���� 250 �ی�ی����ی� ���ی� �ی���� � �ی��ی ��ј ���� ی� ��� (target) �� ������ �����ی ����� �ی���� � ��� ���� (P3b) �� ���� ���ʐی �� ������ 300 �ی�ی����ی� ���ی� �ی���� � �ی����� ���� ��� �� �ی� ��ј ���. ��� P3b ������ ����� P300 ی� P3 ���ی�� �ی����.
��������ی ��
�������ی �����ی ��� ��� �� ���ی� P300
�ј� ���� �� �� �ی�� ���� �ی����� ���ی� ����ی�� ��ǡ
������ ����ی� ���� � ����� �� ��� ���. �� ���ی� �ی� ���Ρ
����� �����ی �� ��ҡ ���� ��������ی ��� ���ی (���ی ����
�ی�����ӡ �ی��� �ی��ی� � �������) � ����ی
���ی ����یی � ��� �ی���ی� �ј� �ی�����(3). P300
�� ��� �ی�ی ���� � ��� ����ʐی ��� �� �� ����ی�
�ј�ی � �� ��ی�� ���� ����� �� �� ����� ύ�� �Ԙ��� ���ی�
����ی ���� ������ �� ����ی �������� �����ی
����
���� ���� ������ ������� � ���� ���� � �������� ����� ����ی�� �� �����
���یۀ �ی���ی ��ʡ ��� �� ����� ���یۀ
�ی���ی �������� ���� �Ԙ�� ���. �� ���� �� �����
��������� � ����ۀ �ی�� �ی� ����� ���� �
���
����ی �� �� ������� ��������ی ���ی ����یی �
���ی� �ی�ی ���� �� ����Ԑ��� �����ۀ �������ی
���ǐ�� �� �� ���ی� �����������. �� ������ی ��ی� �������
��ی��ی �����ۀ P300 ��
��ی�ۀ �������� �����ی � MS ���� �����
���. ��
���� �����ۀ Comi (1999) � ���ی� �����ۀ Adamaszek
� ������� (2006) ���� �ی���� �������� ������ �� ������� ����� �� MS
��ی� ���(4�5).
�� �����ۀ Magnano � ������ (2006) Ellger � ������ (2002) � Polich
�
������ (1992) � Yevtushenko � ������ (2008) ����� �� ���������ی
��� �� MS � ���� ����� �� ��� ����ی ���ی���� ���(9-6). ��
���� �� �ی� �� �� ���� ��������ی ������ی����ی� �������
�� ������� �� ERPs ��ی�
P300 �������� �����ی �� ����� ��ϡ ��� �� ��� ������
���ی�ۀ ����� � ���� ���ʐی �����ی� ������ �� ����� P300
����یی �� ����� MS � ����� ���.
��� ����ی
�� �����ۀ ���� �� �� ��� �ی���������ی � ����� ��ϡ 21 ��� ����� �� MS ���� �� ��� ��Ϙ���ۀ��������ی����� � 27 ��� ����� �� �����ۀ ��ی 50-18 ��� ����ی ����. ����� ����� �� MS ���� 11 ��� � 10 �� ����ی ������ ����� ����� �� �� ����� MS ������ ����. �ی��ی� ��ی ���� 8/27 �� ������ ��ی�� 1/7 ���. ��ۀ ���� �������� �����. ����� ���� ���� MS ������ ��� ��������� ���. �� ���� �ی��ѡ ��� ��� �ی���ی �� 5/1 ��� �� 20 ��� �� �ی��ی� �� ��� � �� ��� ���. ����ۀ ����ی ����� ���� 15 ��� � 12 �� ����� ����� ��� � ������ ����� �� ������ ��� 2/23 �� ������ ��ی�� 8/3 � �� ������ی�� � �������� ���Ԙ�ۀ �������ی ���Ԑ�� ���� ��Ԙی ����� ����� � �� ����ۀ �Ԙ��� ������ی�ی ی� ��ی���ی�ی �������. ����� ���� ������ ������� �����ی ������ ����.
�������ی ������� � ��������ی�ی���ی ���� �ی�ҡ �� ����ی �����ۀ ��Ԙی ����� �� ����� MS� ����坐��� � �� ���� ��������� ����� ��. Ӂӡ �����ۀ ����߁�� ������� ��������� ��� ���ա ��ی����ی �����ی � �������ӡ ��������ی�ی ����� � ���� ���ʐی �����ی� ������ �� ����� P300 ����یی ����� ��. �� �� ����� ����� ������ ������ ����ی� ����� �ی��� � ���ی� �� ������� ����� ��� �ی���. �� ����ۀ ����坐���� �� �� ���� ����ی ����� ����� �ϡ ��� ���� �����ۀ �� ��� ������������ ���ی ����� ����� ����� ��� ���� �� ������ �����ۀ ����ۀ ��� ����� ��ԡ ��ϡ ���� ��ԡ ����������� ����� ����ߡ ����� ����ʡ ���ߡ �����ӡ ������ ������� �� ������� ��������ߡ ����ۀ ���̡ ���� �� �ѡ ���� ����� ������ �� ������� �� ������� ��� ����� �� �ی���ی � ���ی� ��� ������� �� ������ی ���� �� CNS �� 48 ���� ��� ���ی�� ��.
Ӂ� ��� ���� �����ۀ ������� ���� �ی�����. �� ���� ������ ��� ����� �� ���� � ����� ���� ����� ����ѡ ����� ��������ی � ���� ���ی� �� �� �� ��� �� ������� �� ��ʐ�� ������� �������� ��� Zodiac 901 ���� ���� Madsen �����ј ����� �ی���. Ӂ� �� ������� �� ��ʐ�� ������� �� ������ ��� AC 40 ���� ���� Interaucostic �����ј ��������� ����� �� �����ӝ��� 250 �� 8000 ���� ����� �ی���. ���� ������ ����� �����ۀ ������ ���� �� ����� 20 ��ی��� HL �� �����ۀ ������� 8000-250 � ��������� �� �������� ����� (cc6/1-3/0 SC: � ���� ��� ����� 100- �� 100 �ǁ�) � ���� ���ی� ����� ���. �� ���� ���� ����یی ����� �� �� �� ��ԡ ��� ����ی� ����� �� ����ی ���� ����� � ���ۀ ����ی ���� �ی���. Ӂ� ������ی �������� �� ���ۀ �ǘ������ ��ی� �ی��� � �������� �� ����� �� � �����یی� ���� �ی����ʺ �� �ی� ���� �� �� ������ ���� �� ���یۀ Fz (�ی���ی) � ( Cz��ʘ�) � �� ������ �ژ�� �� ���یۀ �����یی� �� ��� ������� ���� ��� (linked) � ی� ������ ���ј �� ���یۀ Fpz (��یی� �ی���ی� �ی� �� ����) ���� �ی�����. �� ���� �� �����ی� ����� ������ ���ی ��� ���ی�ݘ����ی ���ی ��� �� ��� � ��� ���� �ی���ی �� ��� ������ �ی��� �� ������ی� �� �����. �� ����یی �� ��� ���� �ј� ��� �ی��� ���ی ��� ��� �� ������� ������� �� � �� ��� ������ �� �� �� ��� ����ی� ���ۀ �ی� ��� �� �� ی� ���� ���� �� ����. �� �� �ی� ����� �������� �� �ی��� ��������ی�ی������ ��� � ���ی ����ی �� ������ ���� �ی�����.
�� ����ی �� ������ �������� ���� �� ��� �ی�� ��� � ����� ������ �ی� ������ی ���� �� �� �ی�� ��� ��ϡ ����� P300 �� ������� �� �� ��ј �� ���� ��������� 1000 � ��ј ��� 2000 ���� �� ������� �� ���ی ���ی� ������ � �� ����� 200 ��ј (160 ��ј ��������� � 40 ��ј ���) � �� ������ ���� ��ј ��������� 80 ���� � ��ј ��� 20 ���� � �� ��ی� ����ی �� ��� 70 ��ی��� nHL �� ��ʐ�� �����ی� ����ی��� ��� ICS Chartr EP ���� ���� GN Otometric ������ ����� �ی���. ��ǘ ��یی� ���� P300� ����� �� ��� ʘ��� ���� ��� � �� ���� ��ی�یی �� �������� ���� �� ��� ����� �ی���. ���ۀ ��������� �� ��� ������������ ������ۀ �������� ���Ԑ�� ���� ����� ����� � �� �����ۀ ����ی 90-1389 ����� ��.
�� ���� �� ��� �� �� ����� ���� �� ������� ������� ��������� ������� �ی��ϡ ������� ����� �� ��� ������ ����� ���� ��ی���. �� ��� ��� ��� �� ����� �������� ������� ���� �����ۀ ���� ����� ������ � ����� �� ���� �� �� �� ����������ϐ�� ���� �ی���. ����� �� �� ��ی��� ���ی��� ���� �����ۀ ����یԡ ������ ��������� � �� ����ی ���ی�����ۀ ���� �� ����� ���� �ی������. ���� ����� ������� � ����� ������ �����ی� ���� ����� ����� � ���ی ���� �������� �� ��� t ����� ������� ��. ���ی ����ی ���ی� ��ی��� ������ی �� t ���ی ������� ��. ��یۀ ������� �� ������� �� ��������� SPSS ���ۀ 16 ������ �� � 05/0p< ��� ���ی����ی �� ��� ����� ��.
ی�������

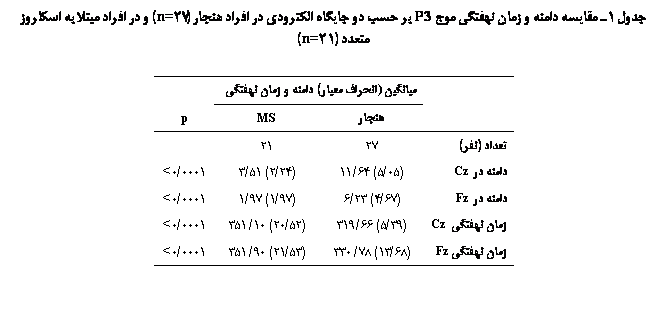
����� � ���� ���ʐی P3 �� ����� ����� � �ی����� ����� �� MS ������ ���� ���� ���ی��ی ���� ����. �� �ی� ����ی��ǡ ������ ����� �� ����� ����� ���ی ��ی��� ������ی Cz� 64/11 � �� ��ی��� ������ی Fz 23/6 ������ ��� � ������ ����� �� ����� �ی��� ���ی ��ی��� ������ی Cz� 51/3 � �� ��ی��� ������ی Fz 38/2 ������ ���. ����� �� ���� �ی����� ����� �� MS �� ���� ����� ���� ��� � �ی� ������ �� ��� ����ی ���ی����(0001/0p<) ��� (���� 1).
�� �ی� ����� ������ ���� ���ʐی P3 �� �� �� ���� ����ی ��. ������ ���� ���ʐی �� ����� ����� ���ی ��ی��� ������ی Cz� 66/319 � �� ��ی��� ������ی Fz 78/330 ������ ��� � ������ ���� ���ʐی �� ����� �ی��� ���ی ��ی��� ������ی Cz� 09/351 � �� ��ی��� ������ی Fz 90/351 ������ ���. ���� ���ʐی ���� MS �� ���� ����� ������ ���ی����ی(0001/0p<) �����ی��� ��� (���� 1).
�� �ی� ������ ���
���ی� �� ���������ی P3 �� ����ی ��. �ی��ی� ����ۀ P3 �� ����
����� �ی��� �� ����� ��ϡ ��ی �ی� ������ �� ����
����ی ���ی���� ����(05/0<p).
���ی� �ی��ی� ����ۀ P3 �� ���� �ی��� �ی��� �� ����� �ی��� ��ϡ ��� ������
���ی����ی ������ ���(05/0<p).
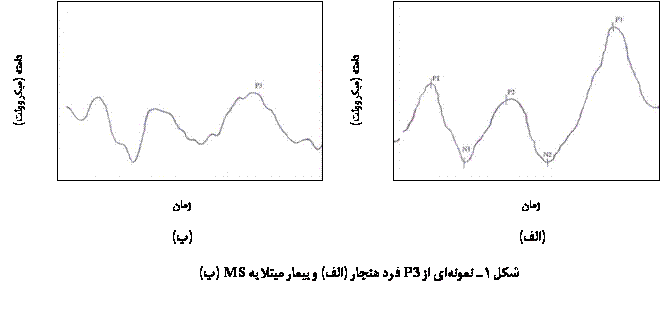
�ی��ی� ���� ���ʐی ��� P3 �� �� �� ��ی��� ������ی �� ����� �ی��� �����ی��� �� ���� �ی����� MS ��ϡ ��ی �ی� ������ �� ���� ����ی ���ی���� ����(05/0<p). �ی� �ی��ی� ���� ���ʐی ��� P3 �� ����� � ���� ����� ������ ���ی ���� ���� �� �� ���� ����ی ���ی���� ����. �� Ԙ� 1 ����ۀ P3 ��� ����� � �ی��� ����� �� MS ����� ��� ���.
���
�� �����ۀ ���� ������ ����� �� ���� ����� � �ی����� ����� �� MS �� ��� ����ی ���ی���� ���. �� ����� �ی�ѡ �ی����� MS ��������ی �捘��ی ���� �� ���� ����� ������ ��������� �� �ی� �ی������ ���������ۀ ������ �� ����� ������ی P3 ���� �� ����� ����� ����. ����ی� ������� ���ی � �����ی�ی ���یی �������� ��یی������ۀ �ی��� ����� ���. �э� �ی����ی �ی���ی ������� ������� ���� ���ϡ ����� ��ѐ��� ����� �� � ��� �� MS �����ی� �� ��� ���� �ی�ی� �������ی ����ی ���� ���ϡ ����� �捘��� �ی����(11).
�ی� ی���� ������ ��
�����ۀ Magnano � ������ (2006)�
Ellger � ������ (2002)� Polich � ������ (1992)� � Yevtushenko � ������ (2008) ������ ����(9-6). �� �ی� ������� �� ����� ����� �� ���� ����� �� MS � ���� ����� �� ��� ����ی ���ی���� ���. ���ی� �� ������ �� �� ��� 2006 ���� Adamaszek � ������� ��� 11 ����� ����� �� MS � 11 ��� ��ی�ی �������� ���� ���� ���� ���ʡ ���� ����� �� ����ۀ P300 �� ����� ����� �� MS ����� ��. ���ی� ����� ���� ���� ��� �� �������� ������������ � ������ ������ �� ������� ����� �� MS �� ��� �� ��� ��� ������ ���ی ���(5). ��ی �ی� ی���� �� �����ۀ Dragan � ������ (2009) ������ی �����(12). �� �����ۀ ���� ������ ����� �� ����� ����� � ����� ����� �� �MS�� ��� ����ی ���ی���� ���� � �� ��� �ی���� ��� �ی� ��� ������ی ����� �� ��� ��� �ی���ی � ����� �� ���������ی ��� ����. ��� ��� �ی���ی �� ������ Dragan ���� �� �����ۀ ���� ���� ���.
�� �����ۀ ���� ���� ���ʐی ���� �ی��� ��
���� ����� �ی��� ��� � �ی� ������ �� ��� ����ی ���ی����
���. ��
����� �ی�ѡ ����� �ی��� ���� ���ʐی �����ی���ی
���� �� ���� ����� ������ ��������� �� �ی������ ���������ۀ ����
���� ������
������� � ���� ���� ���� �� ����� ����� ����.
�ی� ی���� ������ �� ���ی� �����ۀ Dragan � ������ (2009)� Magnano � ������ (2006)� � Ellger � ������ (2002) ����یی ����(6�11�12). �� �ی� ������� �� ����� ���� ���ʐی �� ���� �ی��� � ���� ����� �� ��� ����ی ���ی���� ���. Polich � ������ �� ��������ی �� ��� 1992 �����ی� ������ �� ����� ����ی� � �ی��یی �� ��ی 16 �ی��� ����� �� MS � 16 ��� ����� ����� ����� �� �� �� �� ����� ����� �� MS ���� ���ʐی P300 ������ ���ی����ی �����ی��ѡ � ����� �������� ���. �ی� ������ �� �����ۀ ���� ������ی ����.
�� ������ �ی�� �� �� ��� 1999 �� ������� ���� Comi ���� ���ʡ ����� �� �� ���� ����� �� ��� ������� ����� �� MS ����� ���� � �����ی� ������� ����� ���� � ����� �� �� ��ۀ ����� ������� ی���� ��� ����� ���� �������. �� ������� MS ����ۀ P300 ����ی� ������ ��������� ���� ����� ��� � ���� ���ʐ� �� ������ �� ���� ����� �� ��� ��������� ������ ���� ���. ��� ������� ������ ��������� ����� �� ������ ��� ������� � ���� ������ ��� ���� ��� ���. ����� ��� ������ ���� �� �� ��� �� ����� ������ �� MS �����ی �� ���������ʐ� ���ی������ی � ���ی����ی����ی ���(4). �ی� ������ �� �����ۀ ���� ������ی ����.
�� ����� ���� �� ��� 1992 Van DijK � ������ �������� ����ی��ۀ ����ӡ �����ی����ی ������ �� ������ ������������� � ��������ی ����������ی �� ��ی 30 ��� ����� �� MS � 19 ��� �������� ���� ���� ����� �����. �� �ی� ������ ����� ������������� �� ����� ����� �� MS �ی������ ���. ���� ���ʐی N2 � P3 �� �� ���� �����ی ����� � ��ی� ��ی����ی�ی �� �� ����� ����ۀ ����� MS �����ی� ���� ���� ������ ������� �ی�ʡ ��� �����ی� ���ی� �ј�ی ���(13). �ی� ��ی�� �� ی���ۀ �����ۀ ���� ������ی ����� �� ���� �ی���� �� ��� ����� �� ���������ی ��� � ���ی� ����� �� �یѐ��� �ی����� MS �� �ی� �� ������ ����.
���ی �������ی �� MS �������� �� ���ی���ی� �ی��ی �ی� �ی���ی ی��ی ������ ���ی����� �� ������ ����ی� ��ی ����ی� ���ی ��� �ی������ � �� ����یی �� EPRs ���ی �� ������� �ی� �������ی ���ی ���ی � �ی����ی ��ʡ �ی�ی�����یی � ���ی� ���ی �� MS ���� �������ی�ʐی �������� ���ی �ی� ����ی ���ی � �ی����ی �ی����. �������ی�ʐی �������� ���ی ���� ���ی ���ی� ���ی � �� ��ی�� ���� ��� �������� �����ی �ی� ����ی ���ی � �ی����ی �ی����(11).
�� ���� �� �P300�� �����ی�ی ������� � �� ��� ���� �����ی �������� ��ʡ ������� �� �� �� ���ی�� ����� ��� �ی�����. ���ی�� ����� ���� �����ی �� ��ی� ����� �� �ی���� �������ی �� ���ی���ی�ی� ���� � �� �������ی ����� ���. ���ی��� ��ی��ی ��ی ���ی� �P300�� ����� ��� ��� � �� ���� ���ǡ �����ی ��� ���� ���ʐی P3 �� �� �������� �����ی ���� �ی�����.
�� �ی�� ی�������ی �ی� ����� ����ی ��� ���ی� �� ����� � ���� ���ʐی �� ����� ����� � �ی��� ���. ���ی� ���� �ی���� �� �ی��ی� ����ۀ P300 �� ���� ��ѐ��� �� ����� � ������ ���� ���ʐی �� ���� ���� �� ����� ���. ��� ����� �ی� ����ی� �� �� ���� �� ��� ����ی ���ی���� ����. ����ی� ����� � ���� ���� ���ʐی �� ���� ��� ��� ����ۀ ���� ������ �ی��� � �����یی ���� �� ���� �ی��� ����.
�ی� ی���� �� ��ی�ۀ �����ۀ Polich (1986) ������ی ����(14). ��� Hoffman � ������ (1999) �����ی� ��ѐ��� P300 �� �� ���� �� ���ی�� �� ����� ����� �����(15). �ی� ����� �ی� �� �� ���� ���ی���� ���. �������� ����� ��ی�ۀ �ی� ������ �� ����� ���� �ی������ �ی� ��� ���� �� ���� �� ���� ������� ����ی� P300 �� �� �� ��� ��������ی�ی �������ϡ �ی�� ��� ���� ����ی ��� ���� �� ����ی� P300 ���� ���. �ی� ����� �� ���� ������� ����� ��� � ���ی�ۀ ���ی� �ی� �� ������ ����ی �� ��� ��ی����.
�� �ی� ����� ���ی� �� ��ی��� ������ی ���� �� ����� � ���� ���ʐی ��� ����ی ��. �� ��ی��� ������ی Cz ����ی� ����ۀ �ی��� � ����ی� ���� ���ʐی �������� ���� �� ��ی��� ������ی Fz ������ ��� �� �������� �� �ی� ��� ��� �� ������� ����ۀ ���� P300 �� �� ����� ������� ����� �� ����� �ی���ی/��ی�����ی (Pz) ������� ��� ���. �ѐ�� ������� �������� �� �� ������ �������� ی��ی Fz ���� ���� ����ۀ ���� ���� ������. ������ ���� P3a �� ����� ������� �ی���ی ����� (��� Fz) ������ ������ � ���ی ��� P3b ی� ���� P300 ���� ��� �� ��ی��� ���ی��� �� Fz ������� ���. �ی� ی���� �� �����ۀ Dragan (2009) ������ ���� �� �� ����� �������ی Cz ����ۀ ������ی ���� �� Fz� �� �� ����� ����� � �� �� �ی����� ����� �� MS� ������ ���������. ��� ������ ���� ���� �� ����ۀ ������ �� ����� �������ی Cz �ی� ��� �� �ی� ����� �� ����� ���ی� P3 ���ی���� ���.
���ی �ی� �� ی� ����ی� ����ی �� ����� ��� ����� ��� ��� ��� �� �������ی �������� � ����� �� �� �� ��ی�� ی��ی �ی�� ��� �� �� �� ی�����ی ���� �� ��� ���ǎ ���ی �ј� ����. �� ��ی���� ی��ی� �� �� ی��ی �� �� ��� ����� �ј� �ی����� ��� ��� ی��ی�� �� �� �ی� �����. ������ی� ���ی ���ی� ��ی���� ���ǎی ����ی ���� ��� �� �����ی����ی �ی��� ��� �� ���ی� ��ϡ �ی��� ��ی���� �������� ��ی� �� ��� ���یی �����ی �ј� ����. �� ��� ��������یی �� ���� ���یی ��������ی ���� �� ��� ����� ��� �ی������� �����ی����ی �ی��� ��� �� ���ی� ����.
�����ی����ی ��� �� ��� ���ی� �ی�����. ǐ� ��� ������ی ی� ���� �� ������� �� ��� ����ی �� ���ی� ���� ���� ی� ��� �� ���ی� �ی����� � �ی� ���ی� ���یی ������ �ی������ ���� ���ی� �����ی����ی �ی��� ��� ���. �� ����ۀ ��� �����ی����ی ��� �� ��� ����� ���� ��� ���. �э� ��������ی ���� �� ����� ���� ��� ���ی���� ���ϡ �����ی� ���� ��� ��ѐ��� ���. �� ��� ��ی���ی ������� ����ی���� ������� �����ی �ی�� ������� � �ی� Ԙ� ���یی ����ۀ ���ی� �����ی����ی �ی��� ��� �ی�ی ��ѐ �� ��ی����. ��ی �� ��� ����یی� ǘ�� ������� �� ��� ���ی ����� � ���ۀ ����ی ��ѐی ����� �� ����ی� ���ی ��ѐی �� �� �ی��� ��� ���. ����ی����ی ��ۀ �������ی ���ی ����ی ����� � �ی� ����� �ی�� ����ی �� ����� �ی���� � ���� ���ی� �����ی����ی �ی��� ��� �ی����. �э� ��������ی ���� �� ����� ���� ��� ���ی���� ���ϡ �����ی� ���� ��� ��ѐ��� ���(11).
��� ������ ����� ���� �� ����� �� ��� ���� ���. �� �����ی����ی ���ی ���ی� �ی����� �� ����� ����� �������� � ����� ���ۀ ������ی� ����� ���. �� ����� �� �����ѐ��� ��������� ����� �ی����� �� ����� �����ۀ �������� ������ ���� ������� MS � ���� ����� ������� �������� ����� ���. �� ��ی�� ����� EPRS �� ������� �� �ی��� ���������ی � ���ی� ����� ���� ��������ی �����ی ����� fMRI � ERPs �� ����� ����� �� MS �ی����� �ی����.
��ی����ی�ی
����ی� ���� ���ʐی � ���� ����ۀ ��� P300 �� �ی����� ����� �� MS ���������ۀ ������ �� ����ی� ������� ���ی � ���ی� ���ی ���ی� ���ی � �� ��ی�� ���� ���� ������ ������� � ��������ی ���� ���� �� ����� ����� ���. �� ���� �� �ی� �� �ی����� ����� �� MS �����ی �� �������ی ��EPRS �����ϡ �ی����� �� P300 �������� �����ی ������� �� ���� ��������ی ������ی����ی� �� ����ی �������� �����ی �� MS ���� ����.
Ӂ�Ӑ���ی
�ی� ����� �ѐ���� �� ��ی������ۀ �������ی ���� ���. �� �����ی� ����� ���Ԙ�� �������ی � �ی����� ����� ����� MS Ӂ�Ӑ���ی �ی����.
REFERENCES
1. Kuhlmann T, Lingfeld G, Bitsch A, Schuchardt J, Br�ck W. Acute axonal damage in multiple sclerosis is most extensive in early disease stages and decreases over time. Brain. 2002;125(Pt 10):2202-12.
2. Chermak GD, Musiek FE. Central auditory processing disorders. Singular publishing group. 2006.
3. Hall J. New Handbook of auditory evoked responses. 1st ed. Boston: Allyn & Bacon Education; 2007.
4.
Comi G.
Electrophysiological correlates of
cognitive dysfunction in multiple sclerosis. Electroencephalogr Clin
Neurophysiol. 1997;103(1):53.
5. Adamaszek M, Kr�ger S, Dressel A, Kessler C, Hamm A. Affective impairments in multiple sclerosis proved by event-related potentials and neuropsychology. Clinical Neurophysiology. 2006;117 suppl 1:184-5.
6. Magnano I, Aiello I, Piras MR. Cognitive impairment and neurophysiological correlates in MS. J Neurol Sci. 2006;245(1-2):117-22.
7. Yevtushenko S, Morozova T, Tribrat A, Moskalenko M, Morozova A. The late cognitive evoked potentials latency of children with multiple sclerosis. Int J Psychophysiol. 2008;69(3):247-48.
8. Polich J, Romine JS, Sipe JC, Aung M, Dalessio DJ. P300 in multiple sclerosis. a preliminary report. Int J Psychophysiol. 1992;12(2):155-63.
9. Ellger T, Bethke F, Frese A, Luettmann RJ, Buchheister A, Ringelstein EB, Evers S. Event-related potentials in different subtypes of multiple sclerosis--a cross-sectional study. J Neurol Sci. 2002;205(1):35-40.
10. Margolis RH, Hunter LL. Aucoustic immitance measurments. In: Rosser RJ, Valente M, Hosford-Dunn H, editors. Audiology diagnosis. 2nd ed. New York: Thieme; 2007. p. 381-424.
11. Burkard RF. Electric and magnetic fields of synchronous neural activity. 1st ed. Philadelphia: Williams & Wilkins; 2007.
12. Pokryszko-Dragan A, Zagrajek M, Slotwinski K, Gruszka E, Bilinska M, Podemski R. Neuropsychological testing and event-related potentials in the assessment of cognitive performance in the patients with multiple sclerosis--a pilot study. Clin Neurol Neurosurg. 2009;111(6):503-6.
13. Van Dijk JG, Jennekens-Schinkel A, Caekebeke JF, Zwinderman AH. Are event-related potentials in multiple sclerosis indicative of cognitive impairment? Evoked and event-related potentials, psychometric testing and response speed: a controlled study. J Neurol Sci. 1992;109(1):18-24.
14. Polish J. Normal variation of P300 from auditory stimuli. Electroencephalogr Clin Neurophysiol. 1986;65(3):236-40.
15. Hoffman LD, Polich J. P300, handedness, and corpus callosal size: gender, modality, and task. Int J Psychophysiol. 1999;31(2):163-74.