مقاله مروری
نقش کراتین در حساسیت و عملکرد سیستم شنوایی و دهلیزی
وحید مرادی1، منصوره عادل قهرمان1، اکرم پوربخت2، صوفیا نقدی3، شهره جلایی4
1ـ گروه شنواییشناسی، دانشکده توانبخشی، دانشگاه علوم پزشکی تهران، ایران
2ـ گروه شنواییشناسی، دانشکده علوم توانبخشی، دانشگاه علوم پزشکی ایران، تهران، ایران
3ـ گروه فیزیوتراپی، دانشکده توانبخشی، دانشگاه علوم پزشکی تهران، ایران
4ـ آمار زيستی، دانشکده توانبخشی، دانشگاه علوم پزشکی تهران، ايران
چکیده
زمینه و هدف: پروتئین کراتین در تنظیم انرژی سلولی در اندامهای متقاضی انرژی زیاد از جمله گوش داخلی نقش مهمی ایفا میکند. برای این پروتئین نقش محافظتی نیز قائل شدهاند. در این مطالعه مروری به بررسی اثرات و مکانیزمهای اثر کراتین بر سیستم شنوایی و دهلیزی پرداخته شده است.
یافتههای اخیر: انتقالدهندههای کراتین و همچنین آنزیم کراتینکیناز که در تبدیل کراتین به فسفوکراتین بهعنوان سوخت سلولی نقش دارند، در سلولهای مویی و محافظ حلزونی و دهلیزی، نوار عروقی و نیز مسیرهای عصبی محیطی و مرکزی تا سطح قشر شنوایی موجودند و آدنوزین تریفسفات لازم برای عملکرد سیستم شنوایی و دهلیزی را فراهم میکنند. کراتینکیناز با تنظیم متابولیسم انرژی در لایۀ حاشیهای نوار عروقی و جلوگیری از تولید رادیکالهای آزاد در شرایط استرسزا از آسیب به حلزون جلوگیری میکند و همچنین در جبران دهلیزی نقش دارد. نقص عملکرد آنزیم کراتینکیناز منجر به افزایش آستانۀ پتانسیلهای شنوایی ساقۀ مغز و کاهش عملکرد دهلیزی و مصرف کراتین سبب بهبود پتانسیلهای عضلانی دهلیزی و علائم نورولوژیک میشود.
نتیجهگیری: وجود پروتئین کراتین و آنزیم کراتینکیناز برای عملکرد و حساسیت هنجار سیستم شنوایی و تعادلی ضروری است. نقص آنزیم کراتینکیناز عملکرد این دو سیستم را مختل میکند اما ممکن است مصرف کراتین بتواند سبب تقویت حساسیت سیستم دهلیزی و عملکرد عصبی شود. اثر مصرف کراتین بر سیستم شنوایی هنوز بررسی نشده است.
واژگان کلیدی: کراتین، کراتینکیناز، سیستم دهلیزی، سیستم شنوایی، آدنوزین تریفسفات
(دریافت مقاله: 10/4/93، پذیرش: 5/6/93)
مقدمه
کراتین که در مواد غذایی پروتئیندار از قبیل گوشت به وفور یافت میشود از جمله پروتئینهای غیر ضروری است یعنی توسط خود بدن ساخته میشود، از این رو، نیازی به تأمین آنها از طریق مواد غذایی نیست. مهمترین نقش آن در بدن تأمین انرژی برای اندامهایی است که تقاضای انرژی در آنها بسیار بالا است. انرژی بدن از طریق دو مسیر آهسته و سریع تولید میشود. در مسیر آهسته آدنوزین تریفسفات (Adenosine triphosphate: ATP) از طریق واکنش فسفریلاسیون اکسیداتیو ساخته میشود که انرژی بدن را برای فعالیتهای روزمره و طبیعی فراهم میکند. اما این مسیر آهسته در شرایطی که بدن با فعالیتهای شدید و ممتد روبرو شود نمیتواند انرژی لازم برای عملکرد هنجار در اندام مربوط را فراهم کند. از این رو، حساسیت آن سیستم بهشدت کاهش مییابد. در چنین شرایطی مسیر سریع تولید انرژی بهعنوان یک مسیر مکمل وارد عمل میشود. این مسیر توسط کراتین عملی میشود. در چرخۀ سریع، کراتین توسط آنزیم کراتینکیناز به فسفوکراتین تبدیل میشود. در شرایطی که بدن بهعلت فعالیت شدید در معرض استرس و آسیب قرار دارد فسفوکراتین بهسرعت با آدنوزین دیفسفات (Adenosine Diphosphate: ADP) واکنش میدهد و منبع فراوانی از ATP لازم برای تأمین سوخت سلولی را فراهم میکند(1و2). در مطالعات فراوانی که صورت گرفته است مشخص شده که کراتین میتواند سبب افزایش سطح کراتین خون و متعاقب آن افزایش فسفوکراتین در بدن شود که این افزایش منجر به افزایش منبع انرژی بدن(1و2)، تنظیم متابولیسم و هموستاز انرژی در بدن(3)، کاهش زمان استراحت سلولی (relaxation time)(4) و افزایش دپلاریزاسیون سلولی میشود(5). به واسطۀ این سیستم تأمین انرژی، کراتین میتواند در حفظ عملکرد مناسب سلول در شرایطی که سلول با یک فعالیت شدید و بهمدت طولانی مواجه است ایفای نقش کند و از این رو، حتی نقش محافظتی برای آن قائل شدهاند که میتواند در شرایطی که سلول تحت فشار شدید و طولانی مدت است بهواسطۀ تأمین سریع انرژی از آسیب ساختاری و در نهایت عملکردی جلوگیری میکند. از جمله اندامهای پرتقاضای انرژی که کراتین در آنها ایفای نقش میکند میتوان به عضلات، مغز، قلب و گوش اشاره کرد(6). طبق گزارشات حدود 95 درصد کراتین بدن در ماهیچههای اسکلتی یافت میشود(7). مطالعات با روش اسپکترومتری حجمی (mass spectrometry) که روشی برای تعیین غلظت پروتئین در بدن است نشان دادهاند که آنزیم کراتینکیناز در کل گوش داخلی اعم از حلزون، دهلیز و حتی مسیرهای عصبی از عصب هشتم تا سطح قشر مغزی وجود دارد و در صورت نبود آن سیستم شنوایی و دهلیزی بهشدت دچار افت حساسیت میشوند و مشکلات کمشنوایی و تعادلی را در پی خواهد داشت(8). سیستم شنوایی و دهلیزی بهطور مداوم در معرض تحریک صوتی و فضایی هستند. از این رو، برای فعالیت با حداکثر حساسیت، نیاز به یک سیستم سریع و دائمی تأمین انرژی دارند(9). این تحریکهای مداوم بدون یک سیستم تولید انرژی سریع سبب کاهش عملکرد هنجار سیستم شنوایی و دهلیزی میشوند. به مرور علاوه بر کاهش عملکرد، آسیب ساختاری هم در پی این تحریک مداوم ایجاد خواهد شد که مشکل عملکردی سیستم شنوایی و دهلیزی را دو چندان میکند. وجود کراتین و تولید سریع انرژی بهوسیلۀ آنزیم کراتینکیناز در گوش داخلی و سیستم عصبی شنوایی و دهلیزی موجب جلوگیری از آسیب عملکردی و ساختاری میشود و در شرایط تحریک سریع و پیوسته، عملکرد آنها را با حداکثر حساسیت و کارآیی حفظ میکند(8). از این رو، با توجه به نقش عملکردی و محافظتی که کراتین در سیستم شنوایی و دهلیزی ایفا میکند هدف از این مطالعه مروری بررسی این پرسش است که آیا کراتین بر حساسیت سیستم شنوایی و دهلیزی اثر دارد و در نهایت آیا امکان دارد آزمونهای شنوایی و دهلیزی را متأثر کند.
ویژگیهای فارماکوکینتیک کراتین
کراتین با فرمول شیمیایی C4H9N3O2 و جرم مولی g mol−1 13/131 بهطور طبیعی در بدن از آمینواسیدهای آرژنین (Argenine)، گلیسین (Glycine) و متیونین (Methionine) در کلیه و کبد ساخته میشود و دو آنزیم در کاتالیز آن به این شرح نقش دارند اولی (arginine: glycine amidinotransferase AGAT) است که یک آنزیم میتوکندریایی است و بهطور اولیه در کلیه و پانکراس بیان میشود، و دومی (GAMT)Guanidinoacetate N-methyltransferase است که در کبد و پانکراس بیان میشود(10). در مرحلۀ اول در این فرآیند گلیسین و آرژنین بهوسیلۀ AGAT با هم واکنش میدهند که گوادینواستات و اورنتین حاصل میشوند، سپس در مرحلۀ دوم بهوسیلۀ آنزیم GAMT گروه متیل به گوادینواستات اضافه میشود و کراتین حاصل میشود.
کراتین
بعد از ساخته شدن از طریق خون به ارگان پرتقاضای انرژی از
قبیل مغز، عضله، چشم، سلولهای مویی گوش داخلی و
ماهیچههای صاف معده انتقال داده میشود(11). این پروتئین طی
فرآیند فسفریلاسیون به کمک آنزیم
کراتینکیناز به فسفوکراتین تبدیل میشود.
کراتین کیناز چند زیرمجموعه داردکه عبارتند از: نوع B بیشتر در مغز، نوع M بیشتر در
عضله و نوع میتوکندریایی در بقیۀ اندامها
موجود است و بهطور اختصاصی
در اندام مربوط عمل میکند(12).
میزان هنجار کراتین در سرم خون برابر mg/L 12-2 است. در مطالعات مختلف دریافتهاند که با مصرف حدود 5 گرم کراتین میتوان میزان کراتین خون را پس از 2-1 ساعت به حدود mg/L 120 رساند، نیمۀ عمر این ماده در بدن حدود 3 ساعت است، از این رو برای حفظ مقدار آن بهمدت طولانی در بدن لازم است که هر 6-3 ساعت 5 گرم مصرف شود(13)، و در نهایت مقدار اضافی کراتین که نمیتواند در بدن بماند از طریق کلیهها دفع میشود.
اثر کراتین بر حلزون
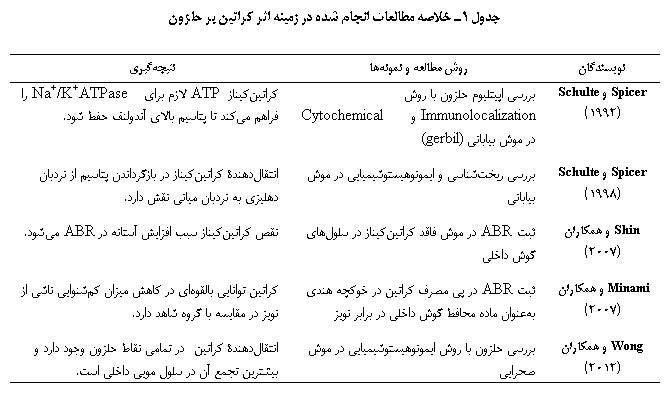
هنگامی که صوت وارد گوش داخلی میشود فعالیتهایی در حلزون برای تبدیل انرژی صوتی به پالسهای الکتریکی صورت میگیرد که تمامی این فعل و انفعالها به انرژی نیاز دارند اما سیستمی مثل سیستم شنوایی که دائم در معرض انواع صداها قرار دارد، برای فعالیت با حداکثر حساسیت نیاز به یک سیستم تأمین انرژی دارد که بتواند دائماً و با سرعت بالا انرژی مورد نیاز برای این اجزاء را فراهم کند. در سیستم انتقال مکانیکی حلزون دستههای مویی به اسم استریوسیلیا دیده میشود که حدود 12-5 میکرومتر طول دارند. این دستهها میتوکندری ندارند از این رو برای دریافت انرژی از میتوکندریهایی که در پایۀ آن قرار دارند، ATP مورد نیاز خود را به روش انتشار (diffusion) تأمین میکنند، اما برای قسمتهای رأسی که در حفظ پمپاژ کلسیم نقش دارند این مکانیسم تأمین انرژی نمیتواند جوابگو باشد، ازاین رو از فسفوکراتین برای تأمین انرژی خود استفاده میکنند. همچنین برای سازگاری که با جابهجایی میوسین در طول استریوسیلیا صورت میگیرد به ATP نیاز است که روش فسفریلاسیون اکسیداتیو تولید انرژی نمیتواند نیاز چنین پدیدۀ سریعی را برطرف سازد(9). در مطالعهای که توسط Shin و همکاران (2007) صورت گرفت مشخص شد حلزون و سیستم دهلیزی همچون سایر اندامهای با تقاضای بالای انرژی، بهخاطر فعالیت شدید و مستمر از کراتین در جهت تأمین انرژی مورد نیاز خود برای حفظ حساسیت بالا استفاده میکنند. کراتینکیناز در حلزون در سلولهای مویی داخلی، خارجی و دایترز و در دهلیز در استریوسیلیا و کاینوسیلیوم سلولهای مویی اتریکول و ساکول شناسایی شده است. بیشترین تجمع این پروتئینها در مناطق سطحی که محل تبادل یون است، دیده میشود، این امر دلیلی محکم برای تأمین انرژی این سلولها بهوسیلۀ فسفوکراتین است. بررسی به روش اسپکترومتری حجمی نشان داده است که پپتیدهای کراتینکیناز نوع B (B-CK) بعد از β-actin بیشترین غلظت را بین پروتئینهای موجود در دستههای مویی داراست(8).
بیان کراتینکیناز در استریوسیلیا برای حفظ حساسیت شنوایی بسیار مهم است و در صورت نقص منجر به کمشنوایی میشود(8). Spicer و Schulte (1998) با مطالعۀ روی موش صحرایی نشان دادند که انتقالدهندههای کراتین در فیبروسیتهای نوع یک رباط مارپیچی وجود دارند و در بازگرداندن پتاسیم از نردبان دهلیزی (scala vestibuli) به نردبان میانی (scala media) نقش مهمی بر عهده دارند(14).در مطالعۀ Wong و همکاران (2012) بر حلزون موش صحرایی به روش immmunolabeling، مشخص شد که انتقالدهندۀ کراتین (creatine transporter) در تمامی نقاط حلزون وجود دارد و بیشترین تجمع آن در سلولهای مویی داخلی و بعد از آنها در سلولهای کلادیوس و نوار عروقی دیده میشود(15).
نقش
محافظتی کراتینکیناز در سیستم
شنوایی و تعادل توسط Ramı´rez-Camacho و همکاران در سال 2006 مطرح شد. براساس فرضیۀ آنها،
کراتینکیناز از جمله آنزیمهایی است که در سلولهای
محافظ حلزون و دهلیز بهواسطۀ نقشی
که در تأمین انرژی دارد از خسته شدن سلول جلوگیری
میکند که سبب جلوگیری
از تولید رادیکالهای آزاد میشود،
از این رو، نوعی نقش محافظتی نیز برای آن درنظر
گرفتهاند که از آسیب شنوایی و تعادلی حاصله از
داروهای اتوتوکسیک، عفونت و صدای بلند جلوگیری
میکند(16). گفته میشود هنگام مواجهۀ
حلزون در برابر محرک شدید، سیستم تأمین انرژی حلزون بهخاطر آزادسازی
رادیکالهای آزاد و کاهش جریان خون در حلزون دچار مشکل

میشود و از این رو حلزون آسیب میبیند. کراتینکیناز یک آنزیم کلیدی در تنظیم متابولیسم انرژی در لایۀ حاشیهای (marginal) نوار عروقی محسوب میشود و ATP لازم برای Na+/K+ ATPase را فراهم میکند تا پتاسیم بالای آندولنف حفظ شود. در شرایطی که حلزون با کمبود انرژی برای انجام فعالیت خود مواجهه است این سیستم تأمین انرژی بهسرعت وارد عمل شده و از آسیب به حلزون و سیستم شنوایی جلوگیری میکند(17). در مطالعهای که توسط Minami و همکاران (2007) انجام شده است مشخص شد که کراتین توانایی بالقوهای در کاهش میزان کمشنوایی ناشی از نویز دارد. در این مطالعه آستانۀ پاسخهای برانگیختۀ شنوایی ساقۀ مغز (auditory brainstem response: ABR) قبل و در روزهای یک و ده بعد از مواجهۀ خوکچۀ هندی با محرک 4000 هرتز با شدت 120 دسیبل SPL بهمدت 5 ساعت اندازهگیری شد و مشخص شد میزان کمشنوایی موقت و دائم در خوکچههایی که کراتین مصرف کرده بودند بهطور بارزی کمتر بود(18). خلاصۀ مطالعات مورد بررسی در جدول 1 آمده است.
اثر کراتین بر اعصاب و راههای مرکزی شنوایی
سیستم عصبی علاوه بر اینکه یک سیستم با تقاضای بالای انرژی است، نوسان انرژی بالایی نیز دارد اما بهطور شگفت انگیزی سطح ATP در آن ثابت میماند که این تنها به کمک یک سیستم تأمین انرژی که عملکرد سریعی دارد مهیا میشود. در این زمینه نقش کراتین، کراتینکیناز و فسفوکراتین در مغز و طناب نخاعی باید مورد توجه قرار گیرد. همانطور که قبلاً گفته شد کراتینکیناز انواع مختلفی دارد. اثبات شده است نوع BB-CK و uMt-CK بهطور اختصاصی در مغز(19)، سلولهای عصبی(20)، گیرندههای حساس به نور در شبکیه(21)، سلولهای مویی گوش داخلی(13) و غیره عمل میکنند.
کراتین بعد از ساخته شدن در کلیه، کبد و پانکراس یا هنگامی که از طریق گوشت جذب شود از طریق خون به مغز میرود، در اینجا بعد از انتقال کراتین به مغز باید از سد خونیـمغزی عبور کند. برای این کار انتقالدهندههای کراتین در قسمتهای داخلی لایۀ اندوتلیال مویرگها بیان شدهاند اما در لایۀ آستروسیت مغزی بیان نشدهاند. از این رو، تنها از طریق قسمتهای بیان شده عبور میکنند. بعد از عبور از سد خونیـمغزی از طریق مایع خارج سلولی به نورونها و الیگودندروسیتها که انتقالدهندۀ کراتینی دارند منتقل میشوند(22). Andres و همکاران (2008) در بررسی مکانیسم عملکردی کراتینکیناز در سیستم عصبی دریافتند هنگامی که کراتین از طریق انتقالدهندۀ کراتینکیناز موجود در جدار سلول وارد نورون میشود به دو روش انرژی را در تأمین میکند مسیر اول از طریق ترکیب فسفوکراتین با کراتینکیناز میتوکندریایی است که در نهایت از طریق transphosphorylation، ATP را تولید میکنند و مسیر دوم از طریق واکنش کراتینکیناز در مسیر گلیکولیز است که در این مسیر علاوه بر تولید ATP یک ذخیرۀ فسفوکراتین (Pool Pcr) برای بافت عصبی فراهم میکند(23).
Dunn-Meynell و همکاران در سال 1998 و Karschin و همکاران (1997) در بررسی دریچههای پتاسیمی حساس به ATP در مغز موش صحرایی به این نتیجه رسیدند که افزایش کراتین خون میتواند سبب تغییرات متابولیسم انرژی در مسیرهای عصبی در مغز شود. گلوکز منبع اولیۀ انرژی برای سلولهای عصبی است و میتواند دپلاریزاسیون نورون و بافتهای عصبی را متأثر کند، از این رو سرعت تحریک سلولهای عصبی با تغییرات این ماده تغییر میکند. در نورونهای عصبی حساس به گلوکز، کانالهای پتاسیمی حساس به ATP وجود دارد که در تنظیم هومیوستاز سلول عصبی نقش دارد به این صورت که تغییرات سطح گلوکز منجر به باز و بسته شدن آنها میشود. تاکنون دو نوع آن، Kir6.1 و Kir6.2، دیده شدهاند. به تازگی مشخص شده است که در صورت کمبود گلوکز، کانالها این توانایی را دارند که از سایر منابع انرژی هم استفاده کنند، یعنی به نوعی میتوانند با تغییر متابولیسم سلولی عملکرد هنجار آن را حفظ کنند و به این ترتیب، نوعی مکانیسم حفاظتی برای سلولهای عصبی هم فراهم میکنند. علت این توانایی دریچهها، تغییر در بیان ژن mRNA است که منجر به توانایی استفاده از سایر منابع انرژی میشود(5و24). با مصرف کراتین میزان ATP به مقدار فراوانی در سلولهای عصبی افزایش مییابد که این افزایش سبب بسته شدن این کانالها و در نتیجۀ افزایش امکان دپلاریزاسیون سلول میشود. از سوی دیگر، مشخص شده است Kir6.2 در هستههای دهلیزی و عضلات نیز وجود دارند(5).
در مطالعهای که توسط Wang و همکاران (1994) در بررسی ارتباط بین فشار مغزی، کراتین کیناز و پاسخهای ABR در 44 بیمار با ادم مغزی حاصل از ضربه صورت گرفت مشخص شد که در بیمارانی که فشار مغزی بسیار بالایی داشتند، ABR بهشدت متأثر میشد و همچنین میزان کراتینکیناز سرم خون آنها بهطور بارزی افزایش مییافت اما در بیمارانی که فشار مغزی کمتری داشتند، ABR کمتر تحت تأثیر قرار گرفته بود و میزان کراتینکیناز سرم خون کمتر افزایش یافته بود. از این رو، نتیجه گرفتند ABR و کراتینکیناز بهطور مؤثری به هم وابستهاند و میتوان با استفاده از میزان کراتینکیناز در سرم خون میزان درگیری ساقۀ مغز در پی ادم مغزی حاصل از ضربه را پیشبینی کرد(25).
Hiel و همکاران (1996) بهکمک روش هیبریداسیون نشان دادند mRNA مسئول کدگذاری انتقالدهندۀ کراتین بهطور گستردهای در سلولهای دوکی شکل هستههای حلزونی پشتی و شکمی، مجموعۀ زیتونی فوقانی، لمینسکوس خارجی و کالیکولوس تحتانی یافت میشود اما تجمع آن در جسم زانویی داخلی و لایۀ مولکولی هستۀ حلزونی پشتی زیاد نبوده است. با این مطالعه مشخص شد که کراتین در سیستم شنوایی و در کلیۀ سطوح عصبی نقش بسیار مهمی در تأمین انرژی لازم برای انتقال سیگنالهای شنوایی دارد(26).
Hetherington
و همکاران (2001) با روش تصویربرداری روی 7 مرد و 3 زن 47-22 ساله هنجار،
وجود فسفوکراتین در مخچه و مادۀ سفید و خاکستری قشر مغز را
نشان دادند و دریافتند که میزان فسفوکراتین در مادۀ
سفید و خاکستری تفاوت معنیداری با هم ندارند. در
این مطالعه اثر کراتین بر
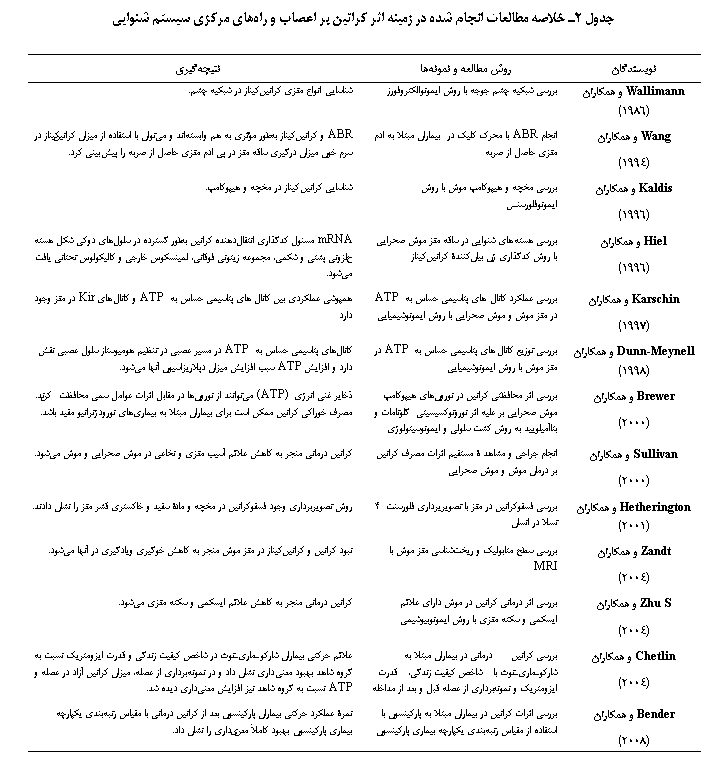
عملکرد مناطق قشری و نیز مخچه که در تنظیم تعادل بدن نقش دارد نشان داده شد(27). بهعلاوه، اهمیت کراتین در مغز با حذف کراتینکیناز و کراتین با دارو در موش مشخص شده است. Zandt و همکاران (2004) نشان دادند که نبود کراتین و کراتینکیناز در مغز موش منجر به کاهش خوگیری و یادگیری در آنها میشود(28). در انسانهایی که سندرم کمبود کراتین داشتند علائمی از قبیل تأخیر گفتار، صرع، کمتوانی ذهنی و اتیسم دیده شده است(29). در سالهای اخیر محققان حوزۀ نورولوژی به کمک کراتین درمانی توانستهاند علائم بیماریهایی از قبیل ایسکمی و سکتۀ مغزی(30)، آسیب مغزیـنخاعی(31)، آلزایمر(32)، هانتیگتون(33)، شارکو ـ ماری ـ توث(34) و پارکینسون(35) را کاهش دهند و عملکرد بیمار را تا حد قابل قبولی ارتقاء دهند که تمامی این بیماریها به نوعی با مکانیسم تزریق انرژی فراوان درمان شدهاند که اساس آن عملکرد کراتین بوده است. خلاصۀ مطالعات مورد بررسی در جدول 2 آمده است.
اثر کراتین بر سیستم دهلیزی
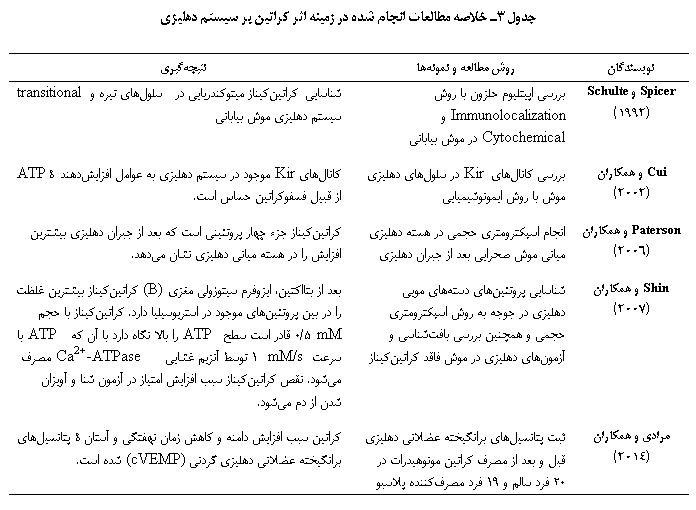
Spicer و Schulte (1992) در مطالعهای روی موشهای مبتلا به نقص آنزیم دوپامین، MM-CK را در سلولهای تیره و transitional سیستم دهلیزی شناسایی کردند و با روش immunolabeling ارتباط کراتینکیناز با Na+/K+ATPase برای فراهم کردن انرژی مورد نیاز سلول در سیستم دهلیزی را نشان دادند. این امر نشاندهندۀ مصرف انرژی زیاد و نیاز بهوجود کراتینکیناز برای تبدیل کراتین به ATP در فرآیند تبدیل ارتعاشات مکانیکی به پالسهای عصبی است(17).
در مطالعهای که توسط Cui و همکاران (2002) انجام شد مشخص شد کانالهای Kir نیز در کل سیتوپلاسم دهلیزی وجود دارند و وجود این مولکولها که بسیار به ATP حساسند میتواند عملکرد دهلیزی را متأثر کند زیرا در صورت وجود کراتین بهشدت میزان ATP در سیتوپلاسم افزایش مییابد. افزایش ATP سبب بسته شدن کانالهای Kir میشود و میتواند روی عملکرد سیستم دهلیزی تأثیرگذار باشد. این مطالعه نشان داد کانالهای Kir به وجود هر عاملی از قبیل فسفوکراتین که سبب افزایش ATP میشوند حساس است(36).
در پژوهشی که توسط Paterson و همکاران (2006) برای بررسی میزان تغییر پروتئینهای موجود در هستۀ دهلیزی داخلی بعد از جبران دهلیزی در موش صحرایی انجام گرفت مشخص شد که از بین بیش از 30 پروتئین بررسی شده، کراتینکیناز با 138 درصد افزایش جزو چهار پروتئینی است که بعد از جبران دهلیزی مقدار آن بیشترین افزایش را نشان میدهد. به این ترتیب مشخص شد که برای جبران دهلیزی پس از لابیرنتکتومی یا هرگونه آسیب به هستههای دهلیزی به میزان بالایی انرژی متابولیک برای gliosis، رشد عصبی و بازسازی سیناپسی نیاز دارد و کراتینکیناز بهخاطر عملکرد خود در تأمین میزان بالای انرژی نقش بسزایی در فرآیند جبران بازی میکند(37). از سوی دیگر، مشخص شده است عملکرد پروتئین غشایی PMCA(plasma membrane Ca2+-ATPase) که مسئول تنظیم مقدار یون کلسیم بوده و در تقویت حلزونی نقش دارد(38) و همچنین سایر آنزیمهای ATPase دستههای مویی، به کراتینکیناز بسیار وابسته هستند. در مطالعۀ Shin و همکاران (2007) روی موش مشخص شد اگر عملکرد کراتینکیناز مهار شود (CK=/=)، عملکرد PMCA و سایر آنزیمها بسیار متأثر میشود که خود منجر به کاهش حساسیت عملکرد حلزون و دهلیز میشود. در این مطالعه عملکرد حلزون و دهلیز بهترتیب با ABR، آزمون شنا و آویزان شدن از دُم بررسی شده است که منجر به افزایش آستانه در ABR در محدودۀ kHz 32-8 و افزایش امتیاز در دو آزمون دهلیزی شده است. این افزایشها دال بر کاهش حساسیت شنوایی و دهلیزی هستند(8). در تنها مطالعۀ انسانی موجود در مورد بررسی اثر مصرف مکمل کراتین بر سیستم دهلیزی مردان غیرورزشکار بهصورت دوسوکور که توسط مرادی و همکاران (2014) صورت گرفته است، مشاهده شد که کراتین بهطور متقارن سبب افزایش معنیدار دامنه و کاهش زمان نهفتگی و آستانۀ پتانسیلهای برانگیختۀ عضلانی دهلیزی گردنی میشود(39). خلاصۀ مطالعات مورد بررسی در جدول 3 تدوین شده است.
مطالعات آینده
باتوجه به مباحث ذکر شده در بالا میتوان استنباط کرد که در صورت افزایش فسفوکراتین بدن در پی مصرف کراتین یا کاهش/نقص آن، احتمال تأثیر بر نتایج آزمونهای شنوایی و دهلیزی وجود دارد. از این رو میتوان در پی مصرف کراتین اثرات اختصاصیتر آن بر آزمونهایی که تاکنون بررسی نشدهاند از جمله گسیلهای صوتی گوش، الکتروکوکلئوگرافی و پاسخهای شنوایی ساقۀ مغز و حتی آزمونهای سطوح بالاتر از قبیل پاسخهای میانرس و دیررس شنوایی و آزمونهای عملکردی دهلیزی را تعیین کرد. در صورتی که این بررسیها در حیوانات آزمایشگاهی انجام شده و با مطالعات بافتی و سلولی مولکولی همراه باشند نتایج جامعتری به همراه داشته و تفسیر یافتهها با دلایل محکمتر و دقیقتری صورت خواهد گرفت.
نتیجهگیری
از آنجا که سیستم شنوایی و تعادلی بهطور دائم در معرض محرکهای صوتی و حرکتی قرار دارند نیاز به یک سیستم تأمینکننده انرژی مطلوب و کارآمد دارند که بتواند بهطور سریع و مستمر ATP لازم را برای این دو سیستم فراهم کند. در بدن چرخۀ سریع تولید انرژی توسط کراتین و تبدیل آن به فسفوکراتین صورت میگیرد. به کمک روشهای immunolabeling و پرتونگاری وجود مقادیر بسیار بالایی از فسفوکراتین و آنزیم کراتینکیناز در تمامی بخشهای حلزونی و دهلیزی، اعصاب آوران، هستههای دهلیزی، مخچه و قشر مغز نشان داده شده است. همچنین دیده شده است کمبود یا نقص در مکانیسم عملکردی فسفوکراتین و آنزیم کراتینکیناز سبب آسیب به چرخه تأمین انرژی و متعاقب آن اختلال در عملکرد سیستم شنوایی و دهلیزی میشود که این موضوع با آزمونهای رفتاری تعادلی و الکتروفیزیولوژیک شنوایی مشاهده شده است. به این ترتیب، میتوان نتیجه گرفت وجود پروتئین کراتین و آنزیم کراتینکیناز برای عملکرد و حساسیت هنجار سیستم شنوایی و تعادلی ضروری است. با توجه به این که تنها یک مطالعه تأثیر مثبت مصرف مکمل کراتین بر عملکرد بخشی از سیستم دهلیزی نشان داده است بهنظر میرسد برای توصیه مصرف آن نیاز به مطالعات بیشتری باشد.
سپاسگزاری
این مقاله حاصل پایاننامۀ کارشناسی ارشد دانشگاه علوم پرشکی تهران است.
1. Spillane M, Schoch R, Cooke M, Harvey T, Greenwood M, Kreider R, et al. The effects of creatine ethyl ester supplementation combined with heavy resistance training on body composition, muscle performance, and serum and muscle creatine levels. J Int Soc Sports Nutr. 2009;6:6.
2. Wallimann T, Dolder M, Schlattner U, Eder M, Hornemann T, O'Gorman E, et al. Some new aspects of creatine kinase (CK): compartmentation, structure, function and regulation for cellular and mitochondrial bioenergetics and physiology. Biofactors. 1998;8(3-4):229-34.
3. Snow RJ, McKenna MJ, Selig SE, Kemp J, Stathis CG, Zhao S. Effect of creatine supplementation on sprint exercise performance and muscle metabolism. J Appl Physiol (1985). 1998;84(5):1667-73.
4. van Leemputte M, Vandenberghe K, Hespel P. Shortening of muscle relaxation time after creatine loading. J Appl Physiol (1985). 1999;86(3):840-4.
5. Dunn-Meynell AA, Rawson NE, Levin BE. Distribution and phenotype of neurons containing the ATP-sensitive K+ channel in rat brain. Brain Res. 1998;814(1-2):41-54.
6. Clark JF. Creatine and phosphocreatine: a review of their use in exercise and sport. J Athl Train. 1997;32(1):45-51.
7. Kreider RB, Melton C, Rasmussen CJ, Greenwood M, Lancaster S, Cantler EC, et al. Long-term creatine supplementation does not significantly affect clinical markers of health in athletes. Mol Cell Biochem. 2003;244(1-2):95-104.
8. Shin JB, Streijger F, Beynon A, Peters T, Gadzala L, McMillen D, et al. Hair bundles are specialized for ATP delivery via creatine kinase. Neuron. 2007;53(3):371-86.
9. Gillespie PG, Cyr JL. Myosin-1c, the hair cell's adaptation motor. Annu Rev Physiol. 2004;66:521-45.
10. Spurr AR. A low-viscosity epoxy resin embedding medium for electron microscopy. J Ultrastruct Res. 1969;26(1):31-43.
11. Greenhaff PL, Bodin K, Soderlund K, Hultman E. Effect of oral creatine supplementation on skeletal muscle phosphocreatine resynthesis. Am J Physiol. 1994;266(5 Pt 1):E725-30.
12. Schlattner U, Tokarska-Schlattner M, Wallimann T. Mitochondrial creatine kinase in human health and disease. Biochim Biophys Acta. 2006;1762(2):164-80.
13. Kamber M, Koster M, Kreis R, Walker G, Boesch C, Hoppeler H. Creatine supplementation--part I: performance, clinical chemistry, and muscle volume. Med Sci Sports Exerc. 1999;31(12):1763-9.
14. Spicer SS, Schulte BA. Evidence for a medial K+ recycling pathway from inner hair cells. Hear Res. 1998;118(1-2):1-12.
15. Wong AC, Velamoor S, Skelton MR, Thorne PR, Vlajkovic SM. Expression and distribution of creatine transporter and creatine kinase (brain isoform) in developing and mature rat cochlear tissues. Histochem Cell Biol. 2012;137(5):599-613.
16. Ramírez-Camacho R, García-Berrocal JR, Trinidad A, González-García JA, Verdaguer JM, Ibáñez A, et al. Central role of supporting cells in cochlear homeostasis and pathology. Med Hypotheses. 2006;67(3):550-5.
17. Spicer SS, Schulte BA. Creatine kinase in epithelium of the inner ear. J Histochem Cytochem. 1992;40(2):185-92.
18. Minami SB, Yamashita D, Ogawa K, Schacht J, Miller JM. Creatine and tempol attenuate noise-induced hearing loss. Brain Res. 2007;1148:83-9.
19. Kaldis P, Hemmer W, Zanolla E, Holtzman D, Wallimann T. 'Hot spots' of creatine kinase localization in brain: cerebellum, hippocampus and choroid plexus. Dev Neurosci. 1996;18(5-6):542-54.
20. Brewer GJ, Wallimann TW. Protective effect of the energy precursor creatine against toxicity of glutamate and beta-amyloid in rat hippocampal neurons. J Neurochem. 2000;74(5):1968-78.
21. Wallimann T, Wegmann G, Moser H, Huber R, Eppenberger HM. High content of creatine kinase in chicken retina: compartmentalized localization of creatine kinase isoenzymes in photoreceptor cells. Proc Natl Acad Sci USA. 1986;83(11):3816-9.
22. Braissant O, Henry H, Loup M, Eilers B, Bachmann C. Endogenous synthesis and transport of creatine in the rat brain: an in situ hybridization study. Brain Res Mol Brain Res. 2001;86(1-2):193-201.
23. Andres RH, Ducray AD, Schlattner U, Wallimann T, Widmer HR. Functions and effects of creatine in the central nervous system. Brain Res Bull. 2008;76(4):329-43.
24. Karschin C, Ecke C, Ashcroft FM, Karschin A. Overlapping distribution of K(ATP) channel-forming Kir6.2 subunit and the sulfonylurea receptor SUR1 in rodent brain. FEBS Lett. 1997;401(1):59-64.
25. Wang WP, Qiu MD, Ren HJ, Zhang XH. Relations of intracranial pressure, creatine kinase and brainstem auditory evoked potential in patients with traumatic brain edema. Chin Med J (Engl). 1994;107(3):205-8.
26. Hiel H, Happe HK, Warr WB, Morley BJ. Regional distribution of a creatine transporter in rat auditory brainstem: an in-situ hybridization study. Hear Res. 1996;98(1-2):29-37.
27. Hetherington HP, Spencer DD, Vaughan JT, Pan JW. Quantitative (31)P spectroscopic imaging of human brain at 4 Tesla: assessment of gray and white matter differences of phosphocreatine and ATP. Magn Reson Med. 2001;45(1):46-52.
28. in 't Zandt HJ, Renema WK, Streijger F, Jost C, Klomp DW, Oerlemans F, et al. Cerebral creatine kinase deficiency influences metabolite levels and morphology in the mouse brain: a quantitative in vivo 1H and 31P magnetic resonance study. J Neurochem. 2004;90(6):1321-30.
29. Wyss M, Kaddurah-Daouk R. Creatine and creatinine metabolism. Physiol Rev. 2000;80(3):1107-213.
30. Zhu S, Li M, Figueroa BE, Liu A, Stavrovskaya IG, Pasinelli P, et al. Prophylactic creatine administration mediates neuroprotection in cerebral ischemia in mice. J Neurosci. 2004;24(26):5909-12.
31. Sullivan PG, Geiger JD, Mattson MP, Scheff SW. Dietary supplement creatine protects against traumatic brain injury. Ann Neurol. 2000;48(5):723-9.
32. Bürklen TS, Schlattner U, Homayouni R, Gough K, Rak M, Szeghalmi A, et al. The creatine kinase/creatine connection to Alzheimer's disease: CK-inactivation, APP-CK complexes and focal creatine deposits. J Biomed Biotechnol. 2006;2006(3):35936.
33. Ryu H, Rosas HD, Hersch SM, Ferrante RJ. The therapeutic role of creatine in Huntington's disease. Pharmacol Ther. 2005;108(2):193-207.
34. Chetlin RD, Gutmann L, Tarnopolsky MA, Ullrich IH, Yeater RA. Resistance training exercise and creatine in patients with Charcot-Marie-Tooth disease. Muscle Nerve. 2004;30(1):69-76.
35. Bender A, Samtleben W, Elstner M, Klopstock T. Long-term creatine supplementation is safe in aged patients with Parkinson disease. Nutr Res. 2008;28(3):172-8.
36. Cui Y, Wang W, Fan Z. Cytoplasmic vestibule of the weak inward rectifier Kir6.2 potassium channel. J Biol Chem. 2002;277(12):10523-30.
37. Paterson JM, Short D, Flatman PW, Seckl JR, Aitken A, Dutia MB. Changes in protein expression in the rat medial vestibular nuclei during vestibular compensation. J Physiol. 2006;575(Pt 3):777-88.
38. LeMasurier M, Gillespie PG. Hair-cell mechanotransduction and cochlear amplification. Neuron. 2005;48(3):403-15.
39. Moradi V, Adel Ghahraman M, Pourbakht A, Naghdi S. Effects of short-term creatine supplement consumption on the cervical vestibular evoked myogenic potentials. [dissertation]. Tehran: School of Rehabilitation, Tehran University of Medical Sciences; 2014.
Review Article
Role of creatine in sensitivity and function of the auditory and vestibular system
Vahid Moradi1, Mansoureh Adel Ghahraman1, Akram Pourbakht2, Soufia Naghdi3, Shohreh Jalaie4
1- Department of Audiology, School of Rehabilitation, Tehran University of Medical Sciences, Iran
2- Department of Audiology, Faculty of Rehabilitation Sciences, Iran University of Medical Sciences, Tehran, Iran
3- Department of Physiotherapy, School of Rehabilitation, Tehran University of Medical Sciences, Iran
4- Biostatistics, School of Rehabilitation, Tehran University of Medical Sciences, Iran
Received: 1 July 2014, accepted: 27 August 2014
Abstract
Background and Aim: Creatine plays an important role in the regulation of cellular energy in high energy demand organs such as the inner ear. It is also believed to play a protective role. This article reviewed the mechanisms and effects of creatine on the auditory and vestibular systems.
Recent Findings: Creatine transporters and creatine kinase enzymes are involved in converting creatine to creatine phosphate. Phosphate is a fuel cell available in the cochlear and vestibular hair cells and the protective cells, striavascularis, peripheral and central neural pathways to the auditory cortex. It provides essential ATP for auditory and vestibular system performance. Creatine kinase prevents cochlear damage by regulating the metabolism of energy in marginal layers of the striavascularis and preventing free radical production in stressful situations. It also plays an important role in vestibular compensation. Creatine kinase dysfunction leads to an increase in the threshold of auditory brainstem potentials and a reduction in vestibular performance. The use of creatine improves vestibular evoked myogenic potentials and neurologic symptoms.
Conclusion: Creatine and creatine kinase protein is essential for normal hearing and balance function and sensitivity. Creatine kinase deficiency impairs the functioning of these two systems; however, creatine consumption may boost the sensitivity of the vestibular system and neurological performance. Effects of the creatine consumption on the auditory system have not yet been examined.
Keywords: Creatine, creatine kinase, vestibular system, auditory system, adenosine triphosphate
Please cite this paper as: Moradi V, Adel Ghahraman M, Pourbakht A, Naghdi S, Jalaie S. Role of creatine in sensitivity and function of the auditory and vestibular system. Audiol. 2015;23(6):45-56. Persian.