لوپوس اریتماتوی سیستمیک (Systemic Lupus Erythematosus: SLE) یک اختلال خودایمن با منشأ ناشناخته است که میتواند ارگانهای مختلف از جمله پوست، مفاصل، کلیه، سیستمهای عصبی، گوارشی، خونی، چشم و شنوایی را درگیر کند(1). در این بیماری کمپلکسهای ایمنی بیماریزا و اتوآنتیبادیها منجر به آسیب ارگانها میشوند(2). میزان بروز این بیماری در سراسر جهان از 5/12 تا 39 مورد در 100000 نفر بوده و در زنان بسیار شایعتر از مردان گزارش شده است. اختلالات شنوایی و تعادل در بیماران مبتلا به لوپوس اریتماتوی سیستمیک ممکن است بهعنوان پیامد آسیب ایمنی گوش داخلی رخ دهد(3). مطالعۀ بیماری ایمنی گوش داخلی (Immune-Mediated Inner Ear Disease: IMIED) ابتدا حدود پنج دهۀ پیش در سال 1958 در آلمان توسط Lehnhart و سپس در ژاپن در سال 1959 توسط Kikuchi شروع شد(1). گوش داخلی دارای یک قابلیت پاسخ ایمنی قوی است. این پاسخها ممکن است بهوسیلۀ سلولهای اختصاصی ایمنی ایجاد شود. این سلولها یا ذاتی هستند یا مشابه آنچه در SLE اتفاق میافتد گردش و رسوب کمپلکس ایمنی شامل مجموعۀ آنتیژن و آنتیبادی هستند. مکانیزم بیماری ایمنی گوش داخلی شامل هیدروپس آندولنف، لابیرنتیت حاد ناشی از آتروفی سلولهای مویی و ساختارهای محافظتی آنها، ازدیاد موضعی یا منتشر بافت فیبروز و استخوان (نئواستئوژنز) و تخریب نورونی است. IMIED سندرمی دارای شروع نسبتاً حاد کاهش شنوایی حسیعصبی بوده و اغلب با وزوز و سرگیجه همراه است. کاهش شنوایی عمیق و کاهش عملکرد دهلیزی از عوارض IMIED است(4).
تاکنون در مطالعات زیادی وجود مشکلات شنوایی را در بیماریهای خودایمن (اتوایمیون) گوناگون مانند گرانولوماتوز وگنر، پلیآرتریت ندوزا، آرتریتروماتوئید، لوپوس اریتماتوی سیستمیک (SLE)، سندرم کوگان و سندرم شوگرن گزارش شده است(2و3). علائم شنوایی گوناگونی در بیماران SLE گزارش شده است. برای اولین بار Kastanioudakis (2002) و Sperling (1998) به وجود SNHL و مشکلات شنوایی دیگر در این بیماران اشاره کردند. وستییبولوپاتی نیز در SLE شایع است(2)، بهطوری که در مطالعات گوناگون شیوع سرگیجه و یا اختلالات تعادل در بیماران مبتلا به SLE از 13 درصد تا 67 درصد گزارش شده است. اختلالات سیستم تعادل ممکن است ناشی از عواملی مانند وجود علائم عصبیـروانی، که در SLE شایع است، آسیب جریان خون مغزی، وجود آنتیبادی علیه بخشهای سیستم عصبی مرکزی (Central Nervous System: CNS) و ناهنجاریهای موجود در ایمنی بافت سیستم دهلیزی باشد(3). از این رو در اقدامات تشخیصی و درمانی، درگیری سیستم شنوایی و دهلیزی باید مورد توجه قرار گیرد. با این وجود، مقالات اندکی در زمینۀ سرگیجه در این بیماری وجود دارد، و این موضوع برای بسیاری از متخصصان گوش، گلو و بینی یک مسئلۀ ناشناخته است. در طول سالهای متمادی تأثیر عوامل بسیاری نظیر فاز فعال بیماری خودایمن، شرححال بالینی و دارودرمانی بررسی شدهاست. محققان اظهار داشتهاند که مشکلات گوش داخلی در این بیماران مستقل از عوامل ذکر شده است(2[Maciaszczyk, 2011 #79]و3). تجربههای بالینی و ناهنجاری در آزمونهای مربوط به سیستم دهلیزی نیز بیانگر ارتباط SLE و اختلال دستگاه دهلیزی است(1و2). Liao و همکاران در سال 2003 یک کودک 11 سالۀ مبتلا به لوپوس را با علائم تب، سردرد و سرگیجۀ شدید همراه با نیستاگموس دو طرفۀ عمودی مورد بررسی قرار دادند. Karatas و همکاران (2007) نتایج ناهنجار بهدست آمده از آزمون الکترونیستاگموگرافی (Electronystagmography: ENG) را در بیماران مبتلا به SLE بهصورت معنیداری بیشتر از افراد گروه شاهد گزارش کردند(2). Zeigelboim و همکاران نیز در سال 2006 در 60 درصد بیماران مبتلا به SLE مورد بررسی، بروز تغییرات در آزمون کالریک را گزارش کردند(1). مطالعات ذکر شده حاکی از وجود ناهنجاری در سیستم دهلیزی بیماران مبتلا به SLE است. همچنین Maciaszczyk و همکاران (2011) با مشاهدۀ افزایش زمان نهفتگی پاسخهای شنوایی ساقۀ مغز (Auditory Braianstem Responses: ABR) وجود درگیری ورای حلزونی و بخش مرکزی مسیر شنوایی را در این بیماران مطرح کردند(3).
در ارزیابیهای گوش، گلو، بینی، شنواییشناسی و نورولوژی، بررسی کامل عملکرد دستگاه دهلیزی بسیار حائز اهمیت است. آزمونهای معمول در ENG تنها به ارزیابی مجرای نیمدایرۀ افقی و عصب دهلیزی فوقانی میپردازند. افزودن (Vestibular Evoked Myogenic Potentials: VEMP) به مجموعه آزمونهای تشخیصی، متخصصان را در بررسی اختلالات ساکول و عصب دهلیزی تحتانی یاری میدهد. VEMP پتانسیلی مهاری است که در پاسخ به اصوات بلند از عضلۀ جناغیـچنبریـماستوئیدی (Sternocleidomastoid: SCM) ثبت میشود. این پتانسیل عملکرد مسیر رفلکس وستیبولوکولیک را نشان میدهد. این رفلکس از سلولهای حساس به صدا در ساکول شروع میشود. سپس سیگنالها از طریق عصب دهلیزی تحتانی به هستۀ دهلیزی تحتانی میرسند و از طریق نوار دهلیزی نخاعی (عمدتاً نوار دهلیزی نخاعی خارجی) به نورونهای حرکتی عضلۀ SCM ختم میشوند. VEMP بهصورت پاسخی دوفازی قابل ثبت است که قطبیت نخستین موج آن مثبت بوده (p13) و به دنبال آن یک قلۀ منفی (n23) ظاهر میشود(5). سودمندی تشخیصی VEMP در اختلالات عصبی و شنواییـدهلیزی گوناگون شامل نوریت دهلیزی، بیماری منیر، سرگیجۀ وضعیتی خوشخیم، شکاف کانال فوقانی، شوانومای دهلیزی و اسکلروز متعدد (Multiple Sclerosis: MS) مورد بررسی قرار گرفته است(5و6). علیرغم گزارش مشکلات سرگیجه و عدم تعادل و وجود ناهنجاری در آزمونهای دستگاه دهلیزی از ENG در بیماران مبتلا به SLE، تاکنون هیچ گزارشی از اجرای VEMP در این بیماران در دسترس نیست(1و2). بهنظر میرسد تاکنون عملکرد بخشی از سیستم دهلیزی، شامل ساکول و مسیر دهلیزیـنخاعی، در بیماران SLE بررسی نشدهاست. از طرفی همان گونه که ذکر شد علائم شنوایی گاهی اوقات بهعنوان اولین نشانۀ بیماری SLE ظاهر میشود. تاکنون SNHL و سرگیجه در بیماران SLE با بسیاری از انواع درمانها بهصورت کلی درمان شده است. اما ما هنوز نمیدانیم که کدام یک از این درمانها در این نوع کاهش شنوایی و سرگیجه مناسبتر و مؤثرتر است. همچنین شناسایی دقیق مکانیزم پاتوژنز مربوط به علائم شنواییـتعادل در این بیماری برای انتخاب رویکرد درمانی بسیار مهم است(2). ازاینرو پژوهش حاضر با هدف مقایسۀ ویژگیهای VEMP شامل میزان وقوع، دامنۀ قله به قله، نسبت عدم تقارن و زمان نهفتگی امواج p13 و n23 در بیماران مبتلا به SLE و افراد هنجار، وجود آسیب احتمالی در ساکول، عصب دهلیزی تحتانی و مسیر VEMP در CNS را بهعنوان بخشهایی از سیستم دهلیزی در بیماران مبتلا به SLE مورد بررسی قرار داد.
روش بررسی
در این مطالعۀ مقطعیـمقایسهای غیر مداخلهای، 26 فرد هنجار (23 زن و 3 مرد) و 20 بیمار مبتلا به SLE در مرحلۀ غیرفعال بیماری (17 زن و 3 مرد) در محدودۀ سنی 50-20 سال که بیماری آنها توسط روماتولوژیست و با استفاده از معیارهای انجمن روماتولوژی آمریکا (American College of Rheumatology: ACR) بهطور قطعی تشخیص داده شده بود، مورد بررسی قرار گرفتند. فعالیت بیماری این بیماران بهاین صورت تعیین شد که بیمارانی که اندیس فعالیت بیماری (SLE disease activity index: SLEDAI) در آنها مساوی یا کمتر از شش بود، غیرفعال تلقی شدند. بیماران براساس مدتزمان ابتلا به بیماری به سه گروه تقسیم شدند: بیماران با سابقۀ بیماری کمتر از 5 سال، بین 10-5 سال و بیشتر از 10 سال(3).
افراد مورد مطالعه بهروش نمونهگیری آسان انتخاب شدند. عدم ابتلا به مشکلات گردنی از جمله آرتروز، نداشتن بیماری در سیستم انتقالی گوش، عدم سابقۀ ضربه به سر و هرگونه پاتولوژی گوش مثل عفونت، بیماریهای متابولیک در هر دو گروه و عدم سابقۀ سرگیجه یا هر نوع اختلال تعادل و کمشنوایی در افراد هنجار شرط لازم برای ورود به مطالعه بود. این اطلاعات از طریق تاریخچهگیری بهدست آمد. پس از کسب رضایتنامه و تکمیل پرسشنامه، برای بررسی دقیق و اطمینان از سلامت گوش میانی، افراد مورد مطالعه تحت معاینۀ اتوسکپی، سنجش شنوایی تن خالص (راه هوایی و استخوانی) در محدودۀ فرکانسی 8000-250 هرتز با استفاده از ادیومتر دوکاناله (ساخت شركت Madsen کشور دانمارک) ، ادیومتری ایمیتانس شامل دو آزمون تمپانومتری و آزمون رفلکس صوتی دگرسویی با استفاده از دستگاه ادیومتر ایمیتانس (ساخت شركت Madsen کشور دانمارك) قرار گرفتند. پس از حصول اطمینان از سلامت سیستم گوش میانی VEMP با استفاده از دستگاه ICS Charter EP (ساخت شرکت GN Otometrics کشور آمریکا) آزمون به این شرح اجرا شد:
از فرد خواسته میشد تا روی صندلی بنشیند. ضمن توضیح دقیق مراحل کار و توجیه دقیق آزمایششونده، جایگاه الکترودها با ژل تمیزکنندۀ پوست، پاک شده و الکترودها در جایگاه مخصوص خود نصب میشدند. امپدانس الکترودها كمتر از پنج كيلواهم و تفاوت امپدانس بین الکترودی کمتر از دو کیلواهم بود. نحوۀ الکترودگذاری بهاینگونه بود که الکترود فعال (غیرمعکوس یا مثبت) روی قسمت میانی عضلۀ SCM، الکترود مرجع ( معکوس یا منفی) روی انتهای بالایی استخوان جناغ و الکترود زمین روی پیشانی قرار میگرفت. لازم بهذکر است که در این مطالعه از الکترودهای صفحهای یکبار مصرف استفاده شد. برای ایجاد انقباض کامل عضلۀ SCM فرد ابتدا سر خود را 30 درجه به سمت جلو، سپس 80 درجه به سمت مخالف عضلۀ مورد آزمایش میچرخاند(7و8). برای کنترل الکترومیوگرافی (Electromyography: EMG) در طول زمان آزمایش (میزان انقباض عضلۀ SCM باید در طول آزمایش ثابت باشد) و ایجاد انقباض برابر در هر دو عضلۀ SCM از روش فیدبک استفاده شد. در این روش، کیسۀ هوای دستگاه فشارسنج تا 20 میلیمتر جیوه باد شده و از آزمایششونده خواسته میشد تا کیسه را بین دست و چانۀ خود قرار دهد و با فشار روی کیسۀ هوا عقربۀ فشارسنج را روی 40 میلیمتر جیوه ثابت نگه دارد. کاهش یا افزایش کوچک فشار بهمیزان دو میلیمتر جیوه پایین یا بالای 40 میلیمتر جیوه پذیرفته میشد(7). همچنین در طول آزمایش از آزمایششونده خواسته میشد علاوه بر اینکه عقربۀ فشارسنج را روی 40 میلیمتر جیوه ثابت نگه میدارد، نگاه خود را روی عدد 40 میلیمتر جیوه ثابت نگه دارد و از نگاه کردن به نقاط و جهات دیگر بپرهیزد، زیرا حرکت چشم بر دامنۀ پاسخ اثر خواهد گذاشت(9). پس از چک کردن مقدار امپدانس، تنظیمات لازم برای ثبت پاسخ در پنجرۀ مربوط به VEMP انجام میشد. محرک تنبرست (500 هرتز) با شدت 95 دسیبل nHL زمان فراز و فرود دو و پلاتو صفر میلیثانیه، پلاریتۀ انبساطی و تعداد 1/5 تحریک در ثانیه از طریق مبدل داخل گوشی ER-3A به گوش ارائه میشد. زمان آنالیزی برابر 100 میلیثانیه و تقویت پنج کیلو و فیلتری با پهنای باند 1500-10 هرتز در نظر گرفته شد. تحریک بهصورت همانسویی بود و تعداد 150 سوئیپ (در هر run) ارائه میشد(10). در هر گوش برای اطمینان از تکرارپذیری پاسخ، آزمون دو بار انجام میگرفت. در بین دفعات تکرار آزمون، به بیمار فرصت داده میشد تا به گردن خود استراحت دهد. در نهایت دامنۀ قله به قلۀ پاسخ، نسبت عدم تقارن و زمان نهفتگی امواج p13 و n23 مورد تجزیه و تحلیل آماری قرار گرفتند. بهمنظور تحلیل دادهها و برای بررسی اثر بیماری SLE بر پارامترهای VEMP بهدلیل برخورداری دادهها از توزیع هنجار که با استفاده از آزمون کولموگروف اسمیرنوف اثبات شد، از آزمون آماری t مستقل و برای بررسی اثر مدت زمان ابتلا به بیماری بر پارامترهای VEMP از آنالیز واریانس یکطرفه استفاده شد. دادهها با نرمافزار SPSS نسخۀ 17 مورد پردازش قرار گرفت.
یافتهها
در مطالعۀ حاضر میزان وقوع، میانگین زمان نهفتگی امواج p13 و n23، دامنۀ قله به قله و نسبت عدم تقارن موج VEMP در بیماران مبتلا به SLE و افراد هنجار مورد مقایسه قرار گرفت. افراد دو گروه از لحاظ سن و جنس همسانسازی شدند. میانگین سنی در افراد گروه هنجار 46/32 سال با انحراف معیار 04/9 و در بیماران مبتلا به SLE، 70/36 سال با انحراف معیار 09/9 بود. همچنین میانگین مدتزمان بیماری در بیماران SLE، 61/10 سال با انحراف معیار 66/5 بود. بین میانگین سنی افراد در دو گروه مورد مطالعه از لحاظ آماری تفاوت معنیداری وجود نداشت(05/0p>). با بررسی اثر جنسیت در هر دو گروه مورد مطالعه، هیچ یک از پارامترهای VEMP بین دو جنس تفاوت معنیدار آماری نشان نداد(05/0p>).
VEMP در تمام افراد دو گروه و در هر دو گوش ثبت شد. بهعبارت دیگر، میزان وقوع پاسخ VEMP در افراد مورد مطالعه 100 درصد بود. در جدول 1 میانگین و انحراف معیار دامنۀ قله به قله، نسبت عدم تقارن موج VEMP و زمان نهفتگی امواج p13 و n23 در دو گروه مورد مطالعه بهتفکیک گوش نشان داده شده است. همانطور که در جدول 1 مشاهده میشود اختلاف آماری معنیداری بین میانگین زمان نهفتگی قلههای p13 و n23 در هر دو گوش افراد دو گروه مورد مطالعه وجود داشت(05/0p<). در واقع میانگین زمان نهفتگی قلههای p13 و n23 در هر دو گوش در بیماران مبتلا به SLE بیشتر از افراد هنجار بود. به این صورت که در بیماران SLE میانگین زمان نهفتگی قلۀ p13 در گوش راست و چپ بهترتیب بهمیزان 34/1 و 22/1 میلیثانیه و میانگین زمان نهفتگی قلۀ n23 در گوش راست و چپ بهترتیب بهمیزان 56/1 و 04/2 میلیثانیه بیش از افراد گروه هنجار بود. میانگین دامنۀ قله به قله موج VEMP در هر دو گوش و نسبت عدم تقارن بین افراد هنجار و بیماران مبتلا به SLE تفاوت معنیدار آماری نشان نداد(05/0p>).
در مطالعۀ حاضر همچنین تأثیر مدتزمان بیماری در بیماران مبتلا به SLE بر پارامترهای موج VEMP مورد بررسی قرار گرفت. جدول 2 میانگین و انحراف معیار میانگین و انحراف معیار دامنۀ قله به قله، نسبت عدم تقارن موج VEMP و زمان نهفتگی امواج p13 را در سه گروه مختلف بیماری بر اساس مدتزمان ابتلا بهتفکیک گوش نمایش میدهد. اطلاعات این جدول حاکی از آن است که مدتزمان بیماری بر هیچ یک از پارامترهای VEMP تأثیری نداشت(05/0p>).
بحث
 در
پژوهش حاضر
ویژگیهای VEMP
شامل درصد
وقوع، دامنۀ قله
به قله و نسبت عدم
تقارن موج VEMP و
زمان نهفتگی
قلههای p13 و n23
در دو گروه
مورد مطالعه
شامل بیماران
مبتلا به
لوپوس
اریتماتوی
سیستمیک و
افراد هنجار
اندازهگیری
و مورد مقایسه
قرار گرفت.
یافتهها
نشان داد که
میانگین زمان
نهفتگی
قلههای p13 و
n23 افراد
مبتلا
به لوپوس
اریتماتوی
سیستمیک
بهصورت معنیداری
بیش از افراد
هنجار است و
این تفاوت در
هر دو گوش
راست و چپ
قابل مشاهده
بود. میزان وقوع
VEMP
در افراد
بیمار مشابه
افراد هنجار و
برابر با 100 درصد بود
و میانگین
دامنه و نسبت عدم
تقارن موج VEMP در بیماران
مبتلا به SLE
با افراد
هنجار در هر
دو گوش از
لحاظ آماری تفاوت
معنیداری
نداشت.
در
پژوهش حاضر
ویژگیهای VEMP
شامل درصد
وقوع، دامنۀ قله
به قله و نسبت عدم
تقارن موج VEMP و
زمان نهفتگی
قلههای p13 و n23
در دو گروه
مورد مطالعه
شامل بیماران
مبتلا به
لوپوس
اریتماتوی
سیستمیک و
افراد هنجار
اندازهگیری
و مورد مقایسه
قرار گرفت.
یافتهها
نشان داد که
میانگین زمان
نهفتگی
قلههای p13 و
n23 افراد
مبتلا
به لوپوس
اریتماتوی
سیستمیک
بهصورت معنیداری
بیش از افراد
هنجار است و
این تفاوت در
هر دو گوش
راست و چپ
قابل مشاهده
بود. میزان وقوع
VEMP
در افراد
بیمار مشابه
افراد هنجار و
برابر با 100 درصد بود
و میانگین
دامنه و نسبت عدم
تقارن موج VEMP در بیماران
مبتلا به SLE
با افراد
هنجار در هر
دو گوش از
لحاظ آماری تفاوت
معنیداری
نداشت.
همانطورکه
ذکر شد در
بیماران
مبتلا به
لوپوس، در مقایسه
با افراد
هنجار،
میانگین زمان
نهفتگی p13 و n23 طولانیتر
بود. تاکنون
هیچ گزارشی از
بررسی VEMP در
بیماران
مبتلا به SLE
در دسترس نیست.
Shimizu
و همکاران (2000) و Murofushi
و همکاران (2001)
افزایش زمان
نهفتگی موج VEMP
را در بیماران
مبتلا به MS و
محققانی از
جمله Akkuzu و همکاران
(2006) و Young و همکاران
(2002) همین یافته
را در بیماران
مبتلا به منیر
گزارش
کردهاند(6،11و12).
همچنین
مطالعۀ Maciaszczyk
و همکاران
(2011)، افزایش 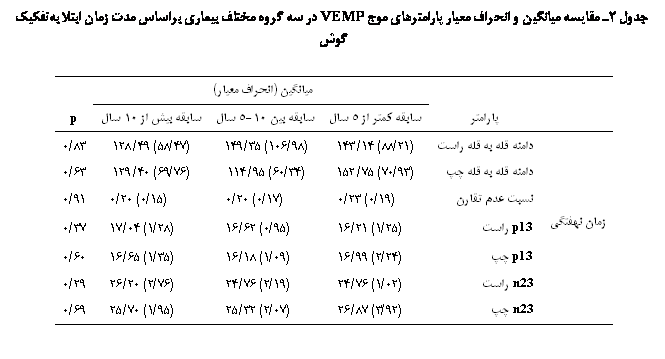 معنیدار
زمان نهفتگی ABR
را در بیماران
مبتلا به SLE
نسبت به افراد
گروه شاهد
نشان داد. این
محققان وجود
درگیری ورای
حلزونی و بخش
مرکزی مسیر
شنوایی را در
این بیماران
مطرح کردند(3). وستیبولوپاتی
مرکزی علت
بارز طولانی شدن
زمان نهفتگی
امواج p13 و n23 ذکر
شده است(13). در
بیماری SLE
ویژگیهای
بالینی و
یافتههای
تصویربرداری
ضایعات
دمیلینهکننده
(اسکلروز
لیپوئید) میتواند
بسیار مشابه
بیماری باشد(14). دمیلینیزاسیون
در ساقۀ مغز
ممکن است
منجر به
تأخیر در زمان
نهفتگی موج VEMP
شود(13). با توجه
به موارد بالا
افزایش زمان
نهفتگی موج VEMP
در بیماری
لوپوس، مشابه
با آنچه در MS
رخ میدهد،
منطقی بهنظر
میرسد. از
آنجا که MS
یک بیماری CNS
است، یافتۀ
محققانی
همچون Shimizu و همکاران
(2000) و Murofushi و همکاران
(2001) نشان میدهد
که ضایعات ساقۀ
مغز، بهویژه
ضایعات مسیر
دهلیزی- نخاعی،
منجر به
افزایش زمان
نهفتگی p13 موج
VEMP
میشود. در
نتیجه،
احتمالاً
افزایش زمان
نهفتگی موج VEMP
در بیماری
لوپوس
نشاندهندۀ
ضایعه در ورای
لابیرنت
بهویژه در
مسیر دهلیزیـنخاعی
باشد(6).
معنیدار
زمان نهفتگی ABR
را در بیماران
مبتلا به SLE
نسبت به افراد
گروه شاهد
نشان داد. این
محققان وجود
درگیری ورای
حلزونی و بخش
مرکزی مسیر
شنوایی را در
این بیماران
مطرح کردند(3). وستیبولوپاتی
مرکزی علت
بارز طولانی شدن
زمان نهفتگی
امواج p13 و n23 ذکر
شده است(13). در
بیماری SLE
ویژگیهای
بالینی و
یافتههای
تصویربرداری
ضایعات
دمیلینهکننده
(اسکلروز
لیپوئید) میتواند
بسیار مشابه
بیماری باشد(14). دمیلینیزاسیون
در ساقۀ مغز
ممکن است
منجر به
تأخیر در زمان
نهفتگی موج VEMP
شود(13). با توجه
به موارد بالا
افزایش زمان
نهفتگی موج VEMP
در بیماری
لوپوس، مشابه
با آنچه در MS
رخ میدهد،
منطقی بهنظر
میرسد. از
آنجا که MS
یک بیماری CNS
است، یافتۀ
محققانی
همچون Shimizu و همکاران
(2000) و Murofushi و همکاران
(2001) نشان میدهد
که ضایعات ساقۀ
مغز، بهویژه
ضایعات مسیر
دهلیزی- نخاعی،
منجر به
افزایش زمان
نهفتگی p13 موج
VEMP
میشود. در
نتیجه،
احتمالاً
افزایش زمان
نهفتگی موج VEMP
در بیماری
لوپوس
نشاندهندۀ
ضایعه در ورای
لابیرنت
بهویژه در
مسیر دهلیزیـنخاعی
باشد(6).
در پژوهش حاضر میزان وقوع VEMP در افراد بیمار، مشابه افراد هنجار و برابر با 100 درصد بود، اگرچه Murofushi و همکاران (2001) فقدان پاسخ VEMP را در تعدادی از بیماران مبتلا به MS و منیر گزارش کردهاند(6). به نظر میرسد با وجود این که ناهنجاریهایی مانند افزایش زمان نهفتگی قلههای p13 و n23 در VEMP افراد مبتلا به لوپوس اریتماتوی سیستمیک مشاهده شد اما احتمالاً شدت ضایعه در حدی نبوده است که منجر به حذف پاسخ در آنها شود. از آنجا که محققان زیادی گزارش کردهاند که مشکلات گوش داخلی در بیماران SLE مستقل از فاز و شدت بیماری است(2[Maciaszczyk, 2011 #79]و3)، بهنظر میرسد که درصد وقوع بالای موج VEMP را نمیتوان به غیرفعال بودن بیماری نسبت داد و در بیماران فاز فعال نیز یافتههایی مشابه با بیماران مورد بررسی (فاز غیرفعال) انتظار میرود.
در این مطالعه میانگین دامنۀ مطلق و نسبت عدم تقارن موج VEMP در بیماران مبتلا به SLE با افراد هنجار در هر دو گوش از لحاظ آماری تفاوت معنیداری نداشت. Shimizu و همکاران (2000) و Murofushi و همکاران (2001) دامنه را در بررسی بیماران MS لحاظ نکرده و بیشتر بر افزایش زمان نهفتگی موج VEMP در این بیماران تأکید داشتند. اگرچه همین محققان گزارش کردند که بیماران مبتلا به منیر بهندرت افزایش زمان نهفتگی موج VEMP را نشان دادهاند، درحالیکه بسیاری از این بیماران کاهش دامنه یا فقدان موج را نشان دادند(6). در مقابل، Waele و همکاران (1999) هیچ تفاوتی را در دامنۀ VEMP بین بیماران مبتلا به منیر و افراد هنجار گزارش نکردند(12). دامنۀ مطلق موج VEMP به شدت صوت و فعالیت عضلۀ SCM وابسته است(7). این پارامتر ارزشمند VEMP بسیار به نقص عملکرد دهلیزی یکطرفه حساس است. همچنین دامنۀ VEMP در بين افراد، بسیار متغير و از 25 ميكروولت تا بيش از 200 ميكروولت است. با توجه به تغییرات زیاد دامنه، دامنۀ مطلق عامل مهمی در تشخیص افتراقی محسوب نمیشود. برای بررسی اختلال عملکرد دهلیزی یکطرفه مقایسۀ نسبت عدم تقارن افراد با یکدیگر منطقیتر بهنظر میرسد. عدم تقارن ناهنجار در دامنۀ VEMP یافتۀ بالینی بارز در اختلال عملکرد دهلیزی یکطرفه است(10). در مطالعۀ حاضر تفاوت میانگین نسبت عدم تقارن موج VEMP بین افراد هنجار و مبتلایان به SLE از لحاظ آماری بارز نبود. این یافته وجود اختلال عملکرد دهلیزی یکطرفه را در این بیماران رد میکند. با توجه به این یافته میتوان گفت عملکرد سیستم دهلیزی دو طرف در این بیماران متقارن بهنظر میرسد.
SLE یک بیماری خودایمن است. مکانیزمهای آسیب گوش داخلی در بیماریهای خودایمن متعدد هستند(3-1). بعضی از تحقیقات در این زمینه واکنشهای ایمنی مستقیم در مقابل بافت گوش داخلی را علت این امر برشمردهاند. Terayama و Sasaki (1968) و Trune و همکاران (1989) آسیب نوار عروقی را در طی واکنش ایمنی به بافت حلزون مشاهده کردند. این احتمال نیز وجود دارد که گوش داخلی بهصورت غیر مستقیم توسط سطوح بالای کمپلکسهای ایمنی و یا ایمنوگلوبولینهای ناشی از بیماری سیستمیک درگیر شده باشد(15). Veldman (1987) فرض کرده است که در بیماری SLE واسکولیت درون حلزون ممکن است نوار عروقی، لیگامنت مارپیچی یا شریان شنوایی داخلی را درگیر کند. Caldarelli و همکاران در سال 1986 اظهار کردهاند که کمپلکسهای ایمنی در حال گردش (در خون) و نه واسکولیت، علت میکروانفارکتوسهای مویرگها یا شریانهای استخوان تمپورال است. Sone و همکاران در سال 1999 در یک مطالعۀ هیستوپاتولوژیک استخوانهای تمپورال در هفت بیمار مبتلا به لوپوس، کاهش سلولهای گانگلیون مارپیچی، درجات مختلفی از کاهش سلولهای مویی و آتروفی نوار عروقی را گزارش کردند(2).
Bouman و همکاران در سال 1998 در یک مطالعۀ تجربی نشان دادند که رسوب کمپلکسهای ایمنی در اطراف ساکول منجر به هیدروپس آندولنف شده بود. رسوب سیستمیک کمپلکسهای ایمنی در SLE ميتواند یک فرایند تخریبی را در گوش داخلی تحریک کند(2). این وضعیت شبیه وضعیتی است که در بیماری منیر رخ میدهد. اگر ناهنجاری در VEMP در بیماری لوپوس اریتماتوی سیستمیک بهدلیل هیدروپس ساکول باشد، افزایش زمان نهفتگی موج VEMP در بیماران SLE با یافتههای محققانی از جمله Akkuzu و همکاران (2006) و Young و همکاران (2002) که افزایش زمان نهفتگی موج VEMP را در بیماری منیر گزارش کردهاند، سازگار است(11و12). Murofushi و همکاران (2001) و برخی از محققان دیگر گزارش کردهاند که در بیماران مبتلا به منیر بهندرت افزایش زمان نهفتگی موج VEMP دیده میشود، در عین حال بسیاری از این بیماران کاهش دامنه یا فقدان موج را نشان میدهند. اين محققان اظهار داشتند که بعید بهنظر میرسد که افزایش زمان نهفتگی موج VEMP نشانۀ ضایعات گوش داخلی باشد(6). ازاینرو در نهایت میتوان گفت افزایش زمان نهفتگی موج VEMP در بیماران SLE و عدم کاهش معنیدار دامنۀ این موج در این بیماران نسبت به افراد گروه شاهد نشان دهندۀ ضایعۀ در ورای لابیرنت بهویژه در مسیر دهلیزیـنخاعی بوده و بعید بهنظر میرسد که این یافتهها نشاندهندۀ ضایعات گوش داخلی از جمله هیدروپس باشد.
در این مطالعه تأثیر مدتزمان ابتلا به بیماری بر میانگین پارامترهای VEMP شامل دامنه، نسبت عدم تقارن و میانگین زمان نهفتگی امواج p13 و n23 بررسی شد. نتایج حاکی از این است که مدتزمان ابتلا به بیماری بر هیچ یک از پارامترهای VEMP تأثیری ندارد. Maciaszczyk و همکاران در سال 2011 گزارش کردند که رابطۀ بین مدتزمان ابتلا به SLE و درجۀ کاهش شنوایی تنها در بیماران گروه سنی کمتر از 49 سال مشاهده میشود و در سنین بالاتر این رابطه مشاهده نمیشود. آنها اظهار داشتند که این یافتهها بیانگر آن است که تأثیر SLE بر شنوایی اغلب در بیماران جوانتر مشاهده میشود و عوامل دیگر نظیر فرایند سالمندی یا دارودرمانی ممکن است در بیماران با سنین بالاتر اثر تجمعی بر حدت شنوایی داشته باشند. همچنین مطالعات گوناگون دیگر نیز نبود رابطه بین مدتزمان ابتلا به بیماری و آزمونهای شنوایی را گزارش کردهاند(3). در واقع، یافتههای گوناگون در مطالعات دربارۀ اثر مدتزمان بیماری بر سیستم شنوایی و تعادل ممکن است ناشی از محدودههای گوناگون مدتزمان بیماری در مطالعات گوناگون یا همزمان متأثر از سن بیماران مورد بررسی در این مطالعات باشد.
نتیجهگیری
یافتههای اصلی این پژوهش شامل افزایش زمان نهفتگی قلههای p13 و n23 در بیماران مبتلا به لوپوس است. اگرچه محل ضایعه که مسئول ایجاد ناهنجاری در VEMP است در ساختارهای دهلیزی محیطی یا مرکزی یا هر دو بهطور قطعی آشکار نیست، با توجه به افزایش زمان نهفتگی قلههای p13 و n23 احتمال وجود ضایعه در ورای لابیرنت، بهویژه در مسیر دهلیزیـنخاعی، وجود دارد. ترکیب VEMP با سایر آزمونهای تعادلی نظیر ENG میتواند در تشخیص محل ضایعه و کمک به انتخاب رویکرد درمانی در بیماران SLE مبتلا به سرگیجه سودمند باشد. به علت محدود بودن تعداد نمونههای مورد بررسی، برای تعمیم نتایج به کل بیماران مبتلا به لوپوس نیاز به تحقیقات گستردهتری است. پیشنهاد میشود تحقیقات مشابه بعدی با حجم نمونۀ بیشتر انجام شود.
سپاسگزاری
این مقاله حاصل طرح پژوهشی دانشگاه علوم پزشکی تهران به شمارۀ 17008-32-01-91 است. به این وسیله از مدیر محترم گروه شنواییشناسی دانشکدۀ توانبخشی دانشگاه علوم پزشکی تهران جناب آقای دکتر فراهانی برای در اختیارگذاشتن امکانات و تجهیزات و حمایتهای بیدریغشان تشکر و قدردانی میشود. همچنین مراتب سپاس و قدردانی از کارکنان مرکز تحقیقات روماتولوژی بیمارستان شریعتی تهران، بهویژه مسئول محترم انجمن لوپوس اریتماتو ایران، سرکار خانم زهرا کمازانی و خانم دکتر مهدیه مدرسی، و نیز تمامی افرادی که در این پژوهش شرکت کردند اعلام میدارد.