
Research Article
The first survey of distribution of inherited deafness patterns in individuals referred to genetic center of Ahvaz welfare organization, Southern Iran
Ali Mohammad Foroughmand1, Hamid Galehdari1, Gholamreza Mohammadian2, Abdolrahman Rasekh3, Jasem Ghavabesh2
1- Department of Genetics, Faculty of Sciences, Shahid Chamran University of Ahvaz, Iran
2- Welfare Organization of Ahvaz, Genetic Counseling Centre, Iran
3- Department of Statistics, Faculty of Mathematical Sciences and Computer, Shahid Chamran University of Ahvaz, Iran
Received: 10 January 2011, accepted: 1 June 2011
Abstract
Background and Aim: Deafness is a heterogeneous disorder induced by genetic and environmental factors. It is the most common hereditary sensory-neural disorder that affects 1/1000 to 1/2000 of the newborns. More than 70% of hearing loss cases are caused by genetic disorders, 85% of which result from nonsyndromic autosomal recessive sensory-neural hearing loss. Up to now, more than 100 genes contributing in hearing loss have been determined. Alteration of these genes may result in hearing loss.
This study was performed to identify the inheritance patterns of deafness and its relation with ethnicity, gender and consanguineous marriages.
Methods: In this survey, data from 356 families affected by hearing loss and referred to welfare organization of Ahvaz during the time were collected based on sex, ethnic groups and relativeness.
Results: The results state a high frequency of autosomal recessive deafness caused by consanguineous marriages within Arab and non-Arab ethnic groups (p<0.05). But no significant difference in gender.
Conclusion: In conclusion, the high frequency of autosomal recessive deafness among the population with a high frequency of consanguineous marriages is considerable. The dominant pattern of deafness observed in this population was autosomal recessive.
Keywords: Syndromic deafness, non-syndromic deafness, inheritance patterns, consanguineous marriages, Arab, non-Arab population
����� ������
����� ����� ������ ��������� ���� �� ���������� ������������ �� �ј� �����ۀ ����� ������ ������� �����
�������� ��������1� ���� ��������1� ������� �������2� ��������� ����3� ���� �����2
1� ���� ����ߡ ������� ���� ���Ԑ�� ���� ����� ����ҡ �ی���
2� �ј� ������ ����ߡ ������� ����ҡ �ی���
3� ���� ���ѡ ������� ���� ����� � ������ѡ ���Ԑ�� ���� ����� ����ҡ �ی���
�����
����� � ���: �� ��� �� 70 ���ϡ �������یی��� �� ���� ������������ ������ ����� ������. ������ ��� �� 100 ���� ��� ����� ��� ��� �� ����� ���� �������� �� ��������� ���� ����. ��� �� ��� ������ ����� ������� ������ ������ �� ����� �������� ������������ �� ������ ������� ����� � ������ �� �� ����� ��� �� ���� ����ʡ ����� � ���������� ��ی�����ی ���.
��� �����: �� ��� ����� ������ 356 ������� ������������ �� �ј� ������ ���ی� ������ ������� ����� ���� ������ ���� ����. ����� ����� �� ��������� �� ���� �� ����ʡ ����� � ����� ����ۀ ��������� ������ ���� �� �� �� ������ ����� � ������ ���� ������ ���� �� ����� ���ۀ ������ ��������� �� ���ۀ ����������� ������ǡ ���������� �����.
��������: ����� ������� ����� ������ی �ی� �� 60 ���ϡ ��������� ���� ����� ���. ������ی ���� ����� ���������ی ��ی�����ی �� ���ی� �ی���� �ی��� �� ��� ���(05/0p<) ����� ���ی����ی �ی� �� ��� �ی�� ���(05/0p>).
����������: �ј��� ������ ��������� ��� �� ����� �� ������� ���������� ��������� ����� ��������� ��� ������������� ������ � ������������� ���� �� ����� ����� ���� ���� � ���� ���� ��������� �� ����� ���� ������� ����� ���.
�ǎ��� �����: ��������� ������� ��������� ���������� ���� �����ی ������ ���������� ��ȡ ������
(��ی��� �����: 20/10/89� ��ی��: 11/3/90)
�����
���� ������ � ��������� �� ��������� ������� ��� �� ����� ��� �� �� ��1000 �� 2000 ����� �� ���� �� ��� ����� ���� ������(5-1). ��� �� ���������� ���� ������ ����� ������ (WHO) ����� ������ ���� ����� � ����ی ����������� �� ���� ��� ��� �������� �� ������ ����یی � ��� ������ ���. �� ���� ����� ����� ���������� ���������� �� �ی� ��� �� �������� ��� ������ �� ��ی� ��یی���� ���ی� ���� ���(6�7).
�� ���� �� ����� �� Prasad � ������(8) � Storm � ������(9) ������� ���� �� ������������� ����� ����� ���� ������ ����ϡ � ���ی� �� ���� ����� Willems 90 ���� ����� ��� ��� �� ���� �������� ������ ����� �������(10).
��� �� 10 ��� ��� �� ��� �������� ������ �� ���� �������� ������ ������� ��� ��ʡ � ������ ���� �� �� ��� ������ ����� ��� ���(1�13-11). ���ۀ ������� ������� ����� ���� �������� ����� ���. ������� ������ ����

������ ������� �� �� ��Ґ� ����� ���� ������� ���� ���� ���� ���ϡ ����ی�� ǐ� �� ��� ���ی ����� ���� ����. �������� ���� ������ۀ ����� �� �� ���� ������ ������ ����� ����� ��� ��� �� ������� ������ ���� �����(11).
�������� ������ ������ �� �� ���ۀ ��������� ������ ������ � ��������� ����� �������. ������ ��� �� 400 ����� ������� ��� ��� �� �� ���� ������ ������ �� ����� ����� �� ������ � ����� ���� ����� ������� �ی��ی�(11�14). ��� �� ���ۀ ��� ی��ی ������������� ������ ���������� ���� ������ �� ����� ��������� ���� ���� ������������ ��� ���� �����ϡ � ������� �� �� ����� �� ���� ��� ����� ��� ���� � �� �� ������ ������ �����ی ��������� � ����������� ������ ������(11).
����� ������� ������ �� ��������� ����� �� ���� ���� � ��� ���. ��� ����� ������ �������� �� ����� ���� ������ � ���������� ���� ����ѐ��� ����. ����� �펐����� ��� ������ � ���������� ���� �� ���� ��� �������� �������� �� ����ۀ ������� ����� � ������ �� ����� �������� ������ ����� ������ ����� ����. ��� ��� �� ����� ������������ �� ����� �� ���� �� ���� ������ � ����� ����� ��� � ������ �� ���� ����� �������� ���� � ���� ���� ����. ��� ����� �������� �� ������� ������� ���� ������ ������������� ���� � ����� ������ �� �����ی ������ ���� ���� ���. ��� �� ��� ����� ����� ������� ������ ������ �� ����� �������� ������������ �� �ј� �����ۀ ���ی� ������ ������� ����� �� ������� 1382-1374 � ������ �� �� ����� ��� �� ���� ����ʡ ����� � ���������� ��ی�����ی ���.
��� �����
�� ��� ����� �����ۀ 356 ������� �� �� ���� ���� ���� ����� ������� (�� ����ۀ �ی� dB 90-56) �� ������� � ی� ���������� ���� �����ۀ ������ �� ������� �� ������� 1382 �� 1374 �� ������� ����� ������ ���� ����� ���� ������ ���� ����. �ی�ی �� �ی� ���ی� �� ����������ی ��� �Ԙی� �ی������. ����� ������� ���� ����� ����� ���� ���� ������� � �� ������� �� ��ʐ������ ����� ����� ����� ��� (��ʐ�� ��ی���� ��� AC5 �ј� Interacoustic� ���� �����ј � ��ʐ�� ��ی���� �ی�ی���� ��� �AZ26�ј� Madsen ���� �����ј). �� ���� �� ������� ���� 650 �� 657 ��� ������� �� ��ی�ۀ ����� (��� � �ی����)� ����� � ����� ����ۀ ��������� ������
���� �� �� �� ������ ����� ���������� ����. �� ��� ����� �� ���� �� ���� ����� �� �� ���� ��� ���ۀ ���������� ���� ���ʡ ��� �� �� ����� ����� �� ���� ����ۀ ���������� ��� ���� �����ی� ����� ����� � ������ � ����� ����� ��������� ����. ���ی ��������� ����� �� ����� ��� �� ������� �����.
��������
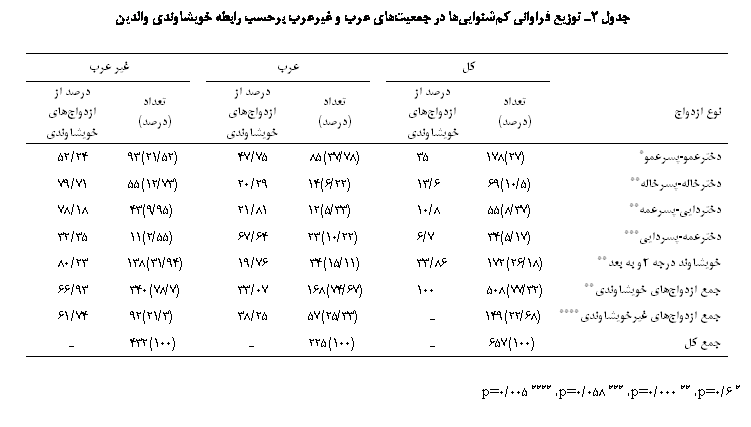
�� ��� ����� ��� �� 60 ���� ���������� ����� ������� ����� ���� �����ی ������� ����� ����� (���� 1). ��� ����� ��� �� ����� ����� ��� ������ ������ ������� ���� � ������ �� ��� ����� ��� (001/0p<). �� ��� ��ѡ ����� ��������� ���ی �� ����� ����� � ������ �� ������ �� ���� ������� ����� ��� ���� 14 ���� �� �� ��������� (���� 1)� ǐэ� �ی� �� ��� ��������ی ���ی����ی �ی� �� ���ی� ���� ����ی ���� �ی�����. ���� ��� �� ��� ����� ������� �������� ������ �� ������ �� ����� ��� ���. ���������� ��ی�����ی �� ������� ��� �� 77 ���� �� ����� ��� ������ ����� (���� 2). ����� �� ��� ���� ������� ��������� ���� �� ��� ������ (��������������� � ���ۀ ����� ���������) � ���� ����� ��������� ������ � ������ �� �� �� �� ���ی ������� � ������ ���ی ��یۀ ����� ���������ی ��ی�����ی ��������ی ���ی����ی ������ �� (���� 2). �� ��� ��� ���������� ��������� ���ۀ 1 �� ��� �� 50 ���� � ���������� ��������� ���ۀ 2 � �� ��� �� ������ ����� � �� ����� ������� ���������� ��������� �� ������ 61 ���� ���. �� ��� ��ѡ ����� ��� ��������� �� �� �� ��� ���� � ��� ������� ����� �� �� ��ϡ ǐ� �� ��������ی ���� ����ی �ی� �� ���ی� �� ��� ������ی ���ی ���� ������ ��� (���� 3). ���� 4 ���� ������ �� ����� ���� ����� ��� ������� ������������� ���� � ������������� ���� �� ����� ����� ���� ����.
���
������������� ������ ������� ������� ���� � ����� � ������ �� X ����� � ���� � ����� �� ���� ������������ ������ ������ϡ �� �� ���� �� ��������ی ���� ��������� ��� ���� ������ ��������� ������������ �� ���� ������� ����� ���(15�16). ǐэ� ������ ������ � ����� ������ � ����� ����� ������ ������ ������ ���� ����� ��� �� ���� �������. �� ����� ���ѡ ���� ����� �� ����� ��ʐ� ����ϡ ��� ������� ����� ����� �� ����� ������ ���� ���� ���.
 �� ����ڡ �� ���� ��
������� ���� ������� ����� �� ��� �� �� ����� � ����� ���� ����� ������ ��
��� ����� ����� �����ۀ ����� �� ��� �������� ���ی ������ �� �����
����ۀ ��������� ���� ����� � ������� ����� ���. ������� �� ����� �������
�� �������� ������ � ����� �� ��� ����� �������� �� ���� ��� ����� ��� ����� ��
������� � ��� ����� ���. ���ی ��������� ��� ����� ����� ������� ��� ����
���. ��� ������� ������� ��������� ���� ������� ����� ���� ����� �� ����� �����ۀ
����ߡ ���� �� ����� �����ۀ ����� �� ��������� ������ �������� �� ����
����� ���� ����.
�� ����ڡ �� ���� ��
������� ���� ������� ����� �� ��� �� �� ����� � ����� ���� ����� ������ ��
��� ����� ����� �����ۀ ����� �� ��� �������� ���ی ������ �� �����
����ۀ ��������� ���� ����� � ������� ����� ���. ������� �� ����� �������
�� �������� ������ � ����� �� ��� ����� �������� �� ���� ��� ����� ��� ����� ��
������� � ��� ����� ���. ���ی ��������� ��� ����� ����� ������� ��� ����
���. ��� ������� ������� ��������� ���� ������� ����� ���� ����� �� ����� �����ۀ
����ߡ ���� �� ����� �����ۀ ����� �� ��������� ������ �������� �� ����
����� ���� ����.
�������� �� �� ���� 1 ������ �ی���� ������� ������������� �� ���� ����� ������� ����� ������� ����� �� �� ��� ������ ������. ��� ����� ���� �����ی �������� �� ��� ���������� ��������� �� ����� ����� �����. �� ���� ����� ������� �� ���� �� ������ ���� ������ی ����� Tabchi � ������ (2000) �� ������� � �Fageeh(2003) �� ����� ��ی� ���� ���� ���(17�18). ���� �� ���� 2 � �����ۀ ���������� ��ی�����ی �� ������� ��� �� 77 ���� ���� �� �������� ����� ��� ���� ��� ������� ����. ���ۀ ���� ��� �� ��� ����� ������� ���������� ��������� ���ۀ 1 �� ��� �� 50 ���� ���. �� ��� ��������� ������� ������� ������ �� ���������� ����������������� ���� �� ��� �� 50 ���� ��� ��������� �� ���������� ���ۀ 1 � 35 ���� ���������� ��ی�����ی �� ��� ���� ���� ����.
�� �����ۀ ��� ���������� ��������� �� ������ ����� ������� �� ��������� ��� � ������ ������ ������ �� ���������� ��������� �������������������� ������������������ ��ی����� ���ۀ 2 � �� ��� �� ������ ���� ����� � ������ ����������������� ������� ����� � ������������������ �� ����� ��� ����� ��ʡ � �� ����� ������� ���������� ��������� �� ������ �� ���� 67 ���� ��� ���� ����� ���. ���� ��� ����� ����� �� ���� ����� ������� ����ء ���� ����� ������� ����� � ��ʐ������ ����������� ������ � ������� ����� ������� � ����� �� �������.
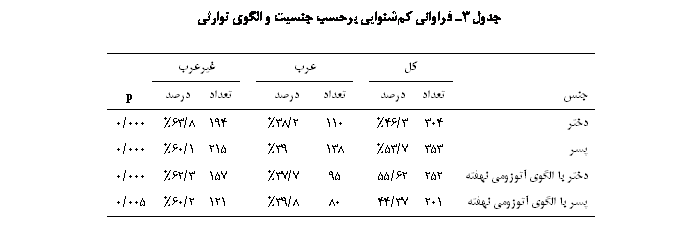
����� �����ی ��������� �� �� �� ��� ���� � ��� ������� ����� �� �� ���. ��� ����ʐ� ���� ������ �� ����� �� �펐����� ������ ����� ������� ����� ��ʡ � ���� ���� �� ������ ������ ����� ������ �� ��� ����� ������ ������ϡ ǐэ� ����� ������ � ������ ����� �� ����� ������ �� ������ �� ���� ���� ����� ����� ��������� �� ����� ��� ��� (���� 3).
��� ���� �� �� ����� � ������� ���� ���� ���� ���� ���� ���ϡ ����� ���� ���� ��� ������������� ���� � ������������� ���� �� ����� ����� ���. �ی� ����� �� �ی� ����� � �� ���ی �����ی �������یی �ی� �� ���ی� ���� ������ ����� ����� ��� (���� 4). �� ����ڡ ����� ��� �� ���� ���� ���� ������ �����ی � ���� ���� ���� ���� ������� ����� ��������� �� ����� �� ������ ��� ���� ������� ������� ����� �� ������ �ѐ�� �� ������������ ����������� �����. �� ��� ��ѡ ����� ���� ������� ����� �� ���� ���� ��������� �� ����� ��� �� ����� ��� � ������ �� ���� ������. ����� �������� ���� ����������� ����� ����ۀ ��ی�����ی �� ���� ���� �� ����� �� ���������� ��� �� ������ ���ی� ����(11�19). ������� ����� ������� ����� ���������� ��������� � ���������� ���� ���� ��� ��������ǡ � ����� ����� ����� ����������� �� ��� �� ���� �����ی ���� ����� �� ������� �� ��� ����� �������� ��� ���� ����� ����� ����.
��ی����ی�ی
�� ����� ������� ��� �� �ј��� �����ۀ ��������� ��� �� ����� �� ������� ���������� ��������� ����� ��������� ��� ������������� ���� � ������������� ���� �� ����� ����� ���� ���ϡ � ���� ���� ��������� �� ����� ���� ������� ����� ���. ����� �� �����ی ���� �� ��ی�ۀ ���������ی ��ی�����ی � ����ۀ �����ۀ ���ی� �� ��� ���ѡ ������� ���ی ����������ی �� ���� ��ѡ �ی����� �� ����� � ���� �������� ���ی �� ���� �������یی ��ی���� ���.
REFERENCES
1. Modamio-Høybjør S, Moreno-Pelayo MA, Mencía A,�del Castillo I, Chardenoux S,�Armenta D, et al. A novel locus for autosomal dominant nonsyndromic hearing loss (DFNA44) maps to chromosome 3q28-29. Hum Genet. 2003;112(1):24-8.
2. Nance WE. The genetics of deafness. Ment Retard Dev Disabil Res Rev. 2003;9(2):109-19.
3. Falk MM. Biosynthesis and structural composition of gap junction intercellular membrane channels. Eur J Cell Biol. 2000;79(8):564-74.
4. Marazita ML, Ploughman LM, Rawlings B, Remington E, Arnos KS, Nance WE. Genetic epidemiological studies of early-onset deafness in the U.S. school-age population. Am J Med Genet. 1993;46(5):486-91.
5. Cohen MM, Gorlin RJ. Epidemiology, etiology, and genetic patterns. In: Gorlin RJ, Toriello HV, Cohen MM, editors. Hereditary Hearing Loss and its Syndromes. NY: Oxford University Press; 1995. p. 9-21.
6. Kudo T, Ikeda K, Oshima T, Kure S, Tammasaeng M, Prasansuk S, et al. GJB2 (connexin 26) mutations and childhood deafness in Thailand. Otol Neurotol. 2001;22(6):858-61.
7. Nekahm D, Weichbold V, Welzl-Mueller K, Hirst-Stadlmann A. Improvement in early detection of congenital hearing impairment due to universal newborn hearing screening. Int J Pediatr Otorhinolaryngol. 2001;59(1):23-8.
8. Prasad S, Cucci RA, Green GE, Smith RJ. Genetic testing for hereditary hearing loss: connexin 26 (GJB2) allele variants and two novel deafness-causing mutations (R32C and 645-648delTAGA). Hum Mutat. 2000;16(6):502-8.
9. Storm K, Willocx S, Flothmann K, Van Camp G. Determination of the carrier frequency of the common GJB2 (connexin-26) 35delG mutation in the Belgian population using an easy and reliable screening method. Hum Mutat. 1999;14(3):263-6.
10. Willems PJ. Genetic causes of hearing loss. N Engl J Med. 2000;342(15):1101-9.
11. Robson CD. Congenital hearing impairment. Pediatr Radiol. 2006;36(4):309-24.
12. Murgia A, Orzan E, Polli R, Martella M, Vinanzi C, Leonardi E, et al. Cx26 deafness: mutation analysis and clinical variability. J Med Genet. 1999;36(11):829-32.
13. Harris KC, Erbe CB, Firszt JB, Flanary VA, Wackym PA. A novel connexin 26 compound heterozygous mutation results in deafness. Laryngoscope. 2002;112(7 Pt 1):1159-62.
14. Sasanfar R, Tolouei A, Hoseinipour A, Farhud DD, Dolati M, Hoghooghi Rad L, et al. Frequency of a very rare 35delG mutation in two ethnic groups of Iranian populations. Iranian J Publ Health. 2004;33(4):26-30.
15. Reardon W. Genetic of deafness. J Med Genet. 1992;29(8):521-6.
16. Lefebvre PP, Van De Water TR. Connexins, hearing and deafness: clinical aspects of mutations in the connexin 26 gene. Brain Res Brain Res Rev. 2000;32(1):159-62.
17. Tabchi B, Rassi B, Akl E, Fares G. Epidemiology of profound neurosensory deafness in Lebanese children. J Med Liban. 2000;48(5):294-7. French.
18. Fageeh NA. Prospective study of hearing loss in schools for deaf children in Assir region, Saudi Arabia. West Afr J Med. 2003;22(4):321-3.
19. Erbe CB, Harris KC, Runge-Samuelson CL, Flanary VA, Wackym PA. Connexin 26 and connexin 30 mutations in children with non-syndromic hearing loss. Laryngoscope. 2004;114(4):607-11.